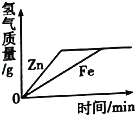
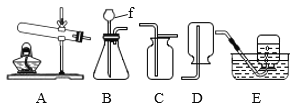题目内容
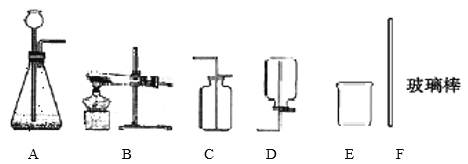
【题目】下面是几种实验室制取气体的发生装置和收集装置.请回答下列问题:
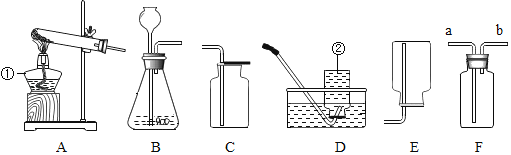
(1)指出图中标有数字的仪器名称:
①_____;②_____.
(2)实验室用双氧水和二氧化锰制取氧气时应选用_____(填字母标号,下同)发生装置,写出用高锰酸钾制取氧气的化学方程式_____;若要收集较为纯净的氧气最好选用_____装置.
(3)F是一种可用于集气、洗气等的多功能装置.若将F装置内装满水,再连接量筒,就可以用于测定不溶于水且不与水反应的气体体积,则气体应从_____(填“a”或“b”)进入F中.
(4)在加热的条件下,用固体碱石灰和污水碳酸钠制取甲烷气体,甲烷是不易溶于水,密度比空气小的无色无味的气体,应选用的发生装置是_____,收集装置是_____.
【答案】酒精灯 集气瓶 B 2KMnO4![]() K2MnO4+MnO2+O2↑ D b A D或E
K2MnO4+MnO2+O2↑ D b A D或E
【解析】
(1)图中标有数字的仪器名称:①是酒精灯,②是集气瓶;
故答案为:酒精灯;集气瓶;
(2)实验室用双氧水和二氧化锰制取氧气属于固-液在常温下反应制取气体,发生装置应选B;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,该反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;氧气的密度比空气大,不易溶于水,可用向上排空气法和排水法收集,但排水法收集的氧气较为纯净;
K2MnO4+MnO2+O2↑;氧气的密度比空气大,不易溶于水,可用向上排空气法和排水法收集,但排水法收集的氧气较为纯净;
故答案为:B;2KMnO4![]() K2MnO4+MnO2+O2↑;D;
K2MnO4+MnO2+O2↑;D;
(3)因为气体的密度小于水的密度,若将F装置内装满水,再连接筒,就可以用于测定不溶于水且不与水反应的气体体积,则气体从b进;
故答案为:b;
(4)用固体碱石灰和无水醋酸钠制取甲烷气体,属于固体加热型,故选发生装置A,甲烷不易溶于水、密度比空气小,所以可用排水法或向下排空气法收集;
故答案为:A;D或E.

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】菱铁矿和赤铁矿一样,也是工业上冶炼铁的一种矿物。某种菱铁矿中铁元素的主要存在形式是碱式碳酸亚铁,为测定碱式碳酸亚铁[xFeCO3yFe(OH)2zH2O]的组成,华雪同在老师的指导下设计了如图实验装置:
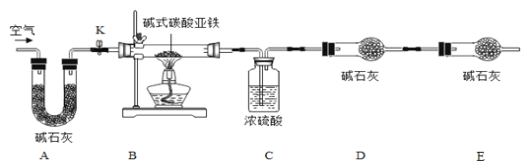
(查阅资料)
a.碱式碳酸亚铁受热会完全分解生成FeO、CO2以H2O。
b.FeO是一种黑色粉末,它不稳定,在空气中加热,可被氧化成四氧化三铁。
c.碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
(实验步骤)
(1)检查装置的_____后,准备称取3.40g碱式碳酸亚铁粉末放在装置B中,连接仪器。
(2)_____,鼓入一段时间空气,准确称量装置C、D、E的质量。
(3)关闭弹簧夹K,加热装置B至装置C中导管末端无气泡冒出,再打开弹簧夹K,缓缓通空气一段时间,这样操作的目的是_____。
(4)再次准确称量装置C、D、E的质量,所得数据如下
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 200.36 | 180.88 | 180.00 |
(5)分析图、表中数据可知:3.40g碱式碳酸亚铁受热分解过程中生成H2O的质量为_____g,CO2的质量为_____g,装置E的作用是_____。
(实验结论)
在xFeCO3yFe(OH)2zH2O中,氢原子与氧原子的个数之比为_____。
(实验反思)
(1)装置A的作用是_____。
(2)实验结束后,装置B中的残留固体可能全部是FeO.也可能全部是Fe3O4.还可能是_____。
(3)为了得到装置B中残留固体的组成,华雪同学称得装置B中残留固体质量为2.24g后,通过计算可知:残留固体的组成及各成分的质量为_____。
【题目】某校兴趣小组在实验室中完成制取氧气的实验。它们取氯酸钾和二氧化锰的混合物共3.0克放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气多少克。
(2)原混合物中氯酸钾的质量分数是多少?