题目内容
水是生命之源,饮用遭到污染的地下水不利于人体健康.政府积极建设自来水厂,让人们喝上清洁的水.
(1)测定地下水的酸碱度可用______.(填标号)
A.紫色石蕊溶液 B.无色酚酞溶液 C.pH试纸
(2)自来水生产过程中,可用______方法除去水中不溶性杂质,再通过活性炭层,利用其______性除去水中的颜色和异味,该过程属于______变化(填“物理”或“化学”).
(3)ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒.请回答下列问题:
①ClO2中“Cl”的化合价是______价.?
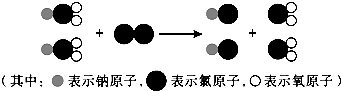
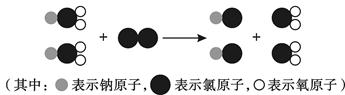
②制取ClO2的反应过程示意图如下:?

该反应的化学方程式为______.
解:(1)使用pH试纸可以测试溶液的酸碱度,酸碱指示剂只能测试溶液的酸碱性,故选C;
(2)过滤能除去水中不溶性杂质,活性炭具有吸附性,能除去水中的颜色和异味,该过程属于物理变化;
(3)ClO2中氧元素的化合价为-2价,根据化合物中正负化合价代数和为0,所以氯元素的化合价为+4价;由微观图可以看出反应物和生成物的化学式分别为:NaClO2、Cl2、NaCl、ClO2,故该反应的化学方程式是2NaClO2+Cl2=2NaCl+2ClO2.
故答案为:(1)C;(2)过滤;吸附;物理; (3)①+4;②2NaClO2+Cl2=2NaCl+2ClO2.
分析:(1)使用pH试纸可以测试溶液的酸碱度,酸碱指示剂只能测试溶液的酸碱性;
(2)根据过滤能除去水中不溶性杂质以及活性炭具有吸附性进行解答;
(3)根据化合物中正负化合价代数和为0以及先推测反应物和生成物的化学式,再书写该反应的化学方程式.
点评:通过给出微粒的模型,考查学生的观察能力和对基本概念的理解与运用能力;熟记常用元素与原子团的化合价;根据题意正确书写化学方程式.
(2)过滤能除去水中不溶性杂质,活性炭具有吸附性,能除去水中的颜色和异味,该过程属于物理变化;
(3)ClO2中氧元素的化合价为-2价,根据化合物中正负化合价代数和为0,所以氯元素的化合价为+4价;由微观图可以看出反应物和生成物的化学式分别为:NaClO2、Cl2、NaCl、ClO2,故该反应的化学方程式是2NaClO2+Cl2=2NaCl+2ClO2.
故答案为:(1)C;(2)过滤;吸附;物理; (3)①+4;②2NaClO2+Cl2=2NaCl+2ClO2.
分析:(1)使用pH试纸可以测试溶液的酸碱度,酸碱指示剂只能测试溶液的酸碱性;
(2)根据过滤能除去水中不溶性杂质以及活性炭具有吸附性进行解答;
(3)根据化合物中正负化合价代数和为0以及先推测反应物和生成物的化学式,再书写该反应的化学方程式.
点评:通过给出微粒的模型,考查学生的观察能力和对基本概念的理解与运用能力;熟记常用元素与原子团的化合价;根据题意正确书写化学方程式.

练习册系列答案
相关题目