题目内容
【题目】某化学兴趣小组同学发现铜绿[Cu2(OH)2CO3]受热分解后,除生成CO2和水蒸气外,试管中还有一些黑色粉末状固体。他们通过实验探究,分析黑色粉末的组成。
(1)提出问题:黑色固体是什么?
(2)猜想与假设:甲认为可能是炭粉(一种碳的单质);乙认为可能是________;
丙认为可能是炭粉和氧化铜的混合物。
三位同学中有一位的假设因为不合理,被另两位同学予以否定,请问是哪一位不合理_____?不合理的原因是______。
(3)查阅资料:氧化铜和炭粉均为黑色固体,其中氧化铜可与稀酸反应而溶解,溶液呈蓝色。炭粉不与稀酸反应,也不溶于稀酸。
(4)设计实验方案:验证另外两位同学的假设。
向试管中的黑色固体滴加足量的_______溶液,待充分反应后,观察固体的溶解情况和所得溶液的颜色。
(5)现象和结论:
若现象为_____,则_____同学猜想正确;
若现象为_____,则______同学假设成立。
(6)若乙的猜想正确,请写出铜绿受热分解的化学方程式_______。
【答案】氧化铜 甲 根据质量守恒定律,化学反应前后原子的种类不能改变,反应物中有铜原子,生成物中不能没有铜原子 稀盐酸或稀硫酸等 黑色固体全部溶解,溶液变为蓝色 乙 黑色固体部分溶解,溶液变为蓝色 丙 Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
【解析】
(2)由题文可知,乙同学的猜想应该是氧化铜,故填氧化铜;
根据质量守恒定律,化学反应前后原子的种类不能改变,生成物中不能没有铜原子,甲猜想的物质中没有铜原子,所以甲同学的猜想不合理,故填甲;
根据质量守恒定律,化学反应前后原子的种类不能改变,反应物中有铜原子,生成物中不能没有铜原子,故填根据质量守恒定律,化学反应前后原子的种类不能改变,反应物中有铜原子,生成物中不能没有铜原子。
(4)氧化铜能与稀盐酸或稀硫酸反应生成氯化铜会硫酸铜,溶于水后得到蓝色溶液,可用该实验来检验氧化铜的存在,故填稀盐酸或稀硫酸等。
(5)如黑色固体中只含氧化铜,加入过量酸液充分反应后,黑色固体全部溶解,同时无色溶液变为蓝色,故填黑色固体全部溶解,溶液变为蓝色;
当观察到黑色固体全部溶解,溶液变为蓝色时,说明黑色固体中只含氧化铜,证明乙同学的猜想正确,故填乙;
如黑色固体中含有氧化铜与炭粉,由于炭粉不能与酸反应,加入过量酸液充分反应后,会观察到黑色固体部分溶解,同时无色溶液变为蓝色,故填黑色固体部分溶解,溶液变为蓝色;
当观察到黑色固体部分溶解,溶液变为蓝色时,说明原黑色固体中除氧化铜外,还有炭粉存在,证明丙同学的猜想正确,故填丙。
(6)若乙的猜想正确,则铜绿受热分解生成氧化铜、二氧化碳和水,故反应的化学方程式写为:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。

【题目】某化学兴趣小组同学,用盐酸和氢氧化钠进行“酸碱中和反应”的探究,进行一段时间后发现没有明显变化,询问老师才知道忘记滴加指示剂。因此,他们停止实验,并在老师的指导下对烧杯内的溶液中的溶质的成分进行探究。
(提出问题)该烧杯内的溶质是什么?
(猜想假设)猜想一:NaCl 猜想二:NaCl和HCl
猜想三:NaCl和NaOH 猜想四:NaCl、NaOH和HCl
同学们讨论后一致认为猜想四不合理,请你说出不合理的理由______________________(用化学方程式表示)。
(查阅资料)NaCl溶液呈中性。
(实验探究)兴趣小组甲、乙、丙三位同学分别设计了如下的实验方案,请你帮助他们完成实验报告的相关内容。
实验方案 | 实验现象 | 实验结论 |
甲同学取少量烧杯内的溶液于试管中,滴入酚酞试液 | 溶液无变化 | 猜想一成立 |
乙同学另取少量烧杯内的溶液于试管中,加入_______。 | 有气泡生成 | 猜想二成立 |
丙同学另取少量烧杯内的溶液于试管中,滴加适量的CuSO4溶液 | 没有蓝色沉淀产生 | 猜想____不成立 |
(评价反思)老师看了甲、乙、丙三位同学的实验报告,指出甲同学的实验结论不准确,请你分析甲同学实验结论不准确的原因:___________。
(得出结论)猜想二成立
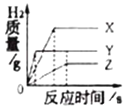
(拓展延伸)某同学在进行酸碱中和滴定实验时,测得溶液的pH变化如下图1所示,请回答下列问题:
(1)由图1可知,该同学实验操作是________________。
A.将盐酸滴入氢氧化钠溶液中
B.将氢氧化钠溶液滴入盐酸中
(2)由图1可知,在b点处溶液中溶质是______________________。
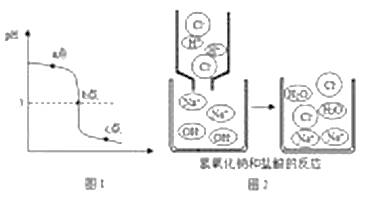
(3)图2为盐酸和氢氧化钠溶液反应的微观过程,从微粒的角度分析,此反应的微观实质_______________(合理答案即可)。
【题目】除去下列物质中的少量杂质,所用试剂和操作都正确的是![]()
![]()
选项 | 物质 | 杂质 | 试剂和操作方法 |
A | 氯化钾 | 二氧化锰 | 加水溶解、过滤、洗涤、干燥 |
B | 氯化钾 | 氯酸钾 | 充分加热 |
C | 水 | 异味 | 加入适量明矾吸附 |
D | 锌 | 铁 | 放入足量硫酸铜溶液,充分反应过滤洗涤、干燥 |
A. A B. B C. C D. D