题目内容
【题目】一种奇妙的蜡烛,点燃后怎么吹也吹不灭,它看上去和普通蜡烛一样,究竟是什么原因能让蜡烛持续燃烧呢?
【查阅资料】普通蜡烛由石蜡和烛芯制成,吹不灭的蜡烛是在烛芯上包裹一层一种金属与少量稀土元素形成的合金粉末,着火点为150℃。蜡烛燃烧时,烛芯里的金属不燃烧;蜡烛一熄灭,未降温的金属就燃烧起来,从而再将蜡烛引燃。
(1)【思考与解释】蜡烛燃烧时,烛芯里的金属为什么不燃烧?
。
(2)【实验探究】小莺通过查阅资料已知吹不灭的蜡烛芯内的金属可能是铜、铁、镁或铝中的一种,为确定该金属成分,请你与他继续探究并完成下列问题。(注:不考虑粉末中稀土元素对探究金属性质的影响)
⑴提出问题:蜡烛芯内的金属究竟是什么?
⑵猜想与假设:猜想一:蜡烛芯内的金属是铜;
猜想二:蜡烛芯内的金属是铁;
猜想三:蜡烛芯内的金属是镁;
猜想四:。
(3)实验验证:
实验 | 操作步骤 | 现象 | 结论 |
Ⅰ | 取出烛芯内的打火石,用砂纸打磨 | 金属是银白色 | |
Ⅱ | 取少量打磨后的打火石于小试管中,滴加适量稀硫酸,观察现象 | 金属逐渐溶解,有无色气体产生,溶液为无色 | |
Ⅲ | 取少量打磨后的打火石于小试管中,加入适量的氯化铜溶液,观察现象 | 有红色物质析出 | 该金属可能是镁 |
a.请写出实验Ⅲ中的化学反应方程式。
b.仅实验Ⅲ中的现象不能证明该金属一定是镁,请说出理由。
(4)讨论交流:
下图是小莺利用数字实验测定的金属与酸反应时装置中压强的变化曲线。请你回答以下问题: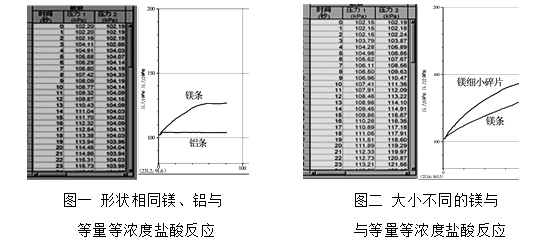
①图一中为什么铝条与酸反应开始一段时间压强变化不大?
②从图一、图二的曲线中找出一条有意义的信息: 。
【答案】
(1)烛芯周围都是石蜡蒸气,氧气很少,烛芯里面的金属难以有足够的氧气燃烧
(2)烛芯内的金属是铝。
(3)该金属一定不是铜;该金属一定不是铁;Mg+CuCl2=MgCl2+Cu;金属铝也能与氯化铜溶液反应,生成红色固体。
(4)铝表面有致密的氧化膜;其它条件相同时,金属颗粒越小,与酸反应速率越快
【解析】【思考与解释】利用燃烧的条件可知灯芯金属不燃烧是因为蜡蒸气起到了隔绝空气的作用;
【实验探究】(2)根据蜡烛烛芯内的金属可能是铜、铁、镁或铝中的一种,故猜想四:蜡烛芯内的金属是铝;(3)打火石是银白色,而铜是紫红色的,所以该金属一定不是铜;根据氯化亚铁的溶液是浅绿色的事实分析可知:取灯芯加入盐酸如果生成无色的溶液则说明有没有铁存在;
金属与盐溶液反应的规律是活动性强的金属可以从盐溶液中置换出活动性比它弱的金属分析可知:实验3中可能会发生Mg+CuSO4=MgSO4+Cu 或 2Al+3CuSO4=Al2(SO4)3+3Cu,由于镁、铝、铜三种金属中铜的活动性最弱,所以镁与铝都可以置换出硫酸铜中的铜,因此不能证明该金属一定是镁也可能是铝;(4)①铝在空气中易被氧气氧化生成致密的氧化铝薄膜起到保护作用,铝条与酸反应开始一段时间压强变化不大;
②金属与酸反应时,先要打磨掉表面的氧化膜。
故答案为:烛芯周围都是石蜡蒸气,氧气很少,烛芯里面的金属难以有足够的氧气燃烧;蜡烛芯内的金属是铝;该金属一定不是铜;该金属一定不是铁;Mg+CuCl2=MgCl2+Cu;金属铝也能与氯化铜溶液反应,生成红色固体;铝表面有致密的氧化膜;其它条件相同时,金属颗粒越小,与酸反应速率越快。
物质的通途由物质的性质决定;物质燃烧的条件有三个:氧气、可燃物、温度达到物质的着火点,三者缺一不可。由此可得到的灭火原理有:隔绝氧气、降低温度至着火点以下、隔离可燃物。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在实验课上,同学们将CO2通入到Ca(OH)2溶液中观察到有白色沉淀生成,而将CO2通入到NaOH溶液中无明显现象。
【提出问题】CO2与NaOH溶液是否发生了化学反应?
【提出猜想】CO2与NaOH溶液发生了化学反应
【实验探究】小明设计出了下列4种实验装置,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低。
(1)实验现象为:A中试管内液面上升,B中 , C中 , D中水槽中的水部分进入烧瓶。
(2)小宁对小明的方案提出了质疑,他认为小明的实验不严谨,其理由是要得到科学严谨的结论,利用方案A,补做的对比实验是。
(3)小丽的改进方案是利用反应后的溶液来验证猜想,请完成实验报告。
实验操作 | 实验现象 | 实验结论 |
向实验后的溶液中加入稀盐酸 | 猜想正确 |
(4)【得出结论】CO2与NaOH溶液发生了化学反应,请写出CO2与NaOH反应的化学方程式:。