题目内容
【题目】水是一种重要的资源。
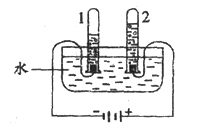
(1)电解水实验揭示了水的组成。下图实验中得到氧气的试管是__________(填“1”或“2”);电解水反应的化学方程式是:__________。电解水的过程中,当2中生成的气体分子数目为n时,1中生成的气体分子数目为__________。
(2)自然界中的水通过蒸发、降水、渗透等物理作用由一个地方移动到另一个地方(如下图所示)。

水蒸发过程中,从微观角度分析,发生变化的是__________(填字母序号)。
A. 分子大小 B. 分子间距离 C. 分子质量
(3)下图是自来水厂净水过程示意图
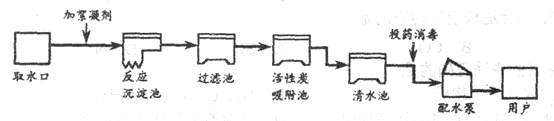
请回答下列问题:
①下列关于水的叙述中,正确的是__________
A. 过滤后的湖水不是纯净物 B. 水体有自净能力,不会被污染
C. 工业废水经处理达标后才能排放 D. 明矾是常用的絮凝剂,可以用来净水
②根据上图信息,生产自来水时使用的净水方法有__________(填字母序号)。
A. 沉淀 B. 过滤 C. 投药消毒 D. 蒸馏 E. 吸附
③利用活性炭去除异味和色素,活性炭的作用是__________。家庭可采用如下图所示装置进行吸附操作,其中水样从下端入水口进入的主要目的是__________。

【答案】 2 2H2O![]() 2H2↑+O2↑ 2n B ACD ABCDE 吸附 使水样和活性炭充分接触
2H2↑+O2↑ 2n B ACD ABCDE 吸附 使水样和活性炭充分接触
【解析】电解水实验中,与正极相连的电极产生的是氧气,与负极相连的电极产生的气体是氢气,故2管中是氧气; 该反应是水在通电的条件下生成氢气和氧气,反应方程式为: 2H2O 通电 2H2↑+ O2↑;电解水的实验中,负极产生的氢气的体积是正极产生的氧气的体积的2倍,体积比等于分子个数比,故1中生成的分子数目为2n;
水的蒸发是水分子之间的间隙变大的原因,而分子的种类没有变化,故选B;
①A、过滤后的水将固体杂质除去,而溶于水中的可溶性杂质没有除去,故仍然是混合物,正确;B、水体有一定的自净能力, 但是由一定的程度,故我们要保护水资源,错误;C、工业废水不能直接排放,会污染水源,需要处理合格后才能排放,正确;D、在沉淀过程中,为了加快沉淀的速率,可以加入明矾,利用明矾溶于水形成的胶状物吸附固体小颗粒,加速沉淀,正确;故选ACD;
②自来水的净水方法有沉淀、过滤、吸附、消毒、蒸馏,故选:ABCDE;
③活性炭具有吸附性,可以吸附色素和异味; 当水从下端进入上端出来时,水可以与活性炭层进行充分的接触。

 名校课堂系列答案
名校课堂系列答案【题目】常温下,小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡的速率有快有慢,于是他与小芳同学一起合作进行如下探究。
【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
【设计并实验】小明和小芳进行如下实验。
实验 编号 | 盐酸的 浓度 | 金属 (均取2 g) | 金属的 形状 | 收集50 mL 氢气所需要 的时间/s |
① | 10% | 镁 | 粉状 | 60 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 镁 | 片状 | 102 |
④ | 20% | 铁 | 片状 | 110 |
(1)实验时需将镁片和铁片进行打磨,其目的是____________________________。
(2)写出铁与稀盐酸反应的化学方程式:________________________________。
【收集证据】
(3)要比较金属的种类对反应快慢的影响,应选择的实验编号是________。
【得出结论】通过上述四个实验,你得出的影响金属与酸反应的因素有____________________。
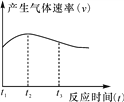
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得镁与稀盐酸反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t1~t2 时间段内反应速率逐渐加快的主要原因是_________________, t2~t3时间段内反应速率逐渐减慢的主要原因是___________________。