题目内容
【题目】对比实验是科学研究中常用的方法。
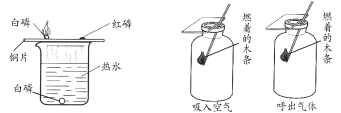
甲 乙
(1)甲实验证明可燃物燃烧的条件之一是温度达到着火点,依据的实验现象是______。
(2)乙实验的目的是比较吸入空气和呼出气体中______的含量。
【答案】铜片上的白磷燃烧,红磷不燃烧 氧气
【解析】
证明可燃物必须达到一定温度(着火点)才能燃烧,要控制其它条件相同,温度不同。铜片上的白磷与氧气接触,在此温度条件下燃烧产生白烟,铜片上的红磷与氧气接触,在此温度条件下不能燃烧;说明可燃物必须达到一定温度(着火点)才能燃烧。甲实验证明可燃物燃烧的条件之一是温度达到着火点,依据的实验现象是铜片上的白磷燃烧,红磷不燃烧;
(2)木条燃烧需要氧气,乙实验中,呼出气体中的燃着木条熄灭,吸入空气中的燃着木条无明显变化,说明呼出气体中氧气含量比吸入空气少。乙实验的目的是比较吸入空气和呼出气体中氧气的含量。

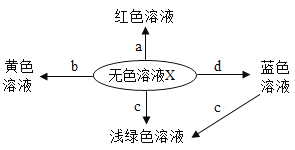
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:

(1)A试管中的实验现象为_____,C试管中所发生反应的化学方程式为_____。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想一:NaCl 猜想二:NaCl和CaCl2
猜想三:_____ 猜想四:NaCl、Ca(OH)2和HCl
(交流讨论)同学们经过讨论后一致认为猜想_____不正确。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _____ | 猜想二不成立 |
取少量滤液于试管中,滴加_____(填名称)。 | _____ | 猜想三成立 |
【题目】小宇为了测定实验室中氯酸钾样品的纯度,取10g样品与1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 9.68 | 9.04 | 7.16 | 7.16 |
试计算:
(1)完全反应后产生的氧气的总质量为_____________g;
(2)样品中氯酸钾的纯度是____(写出计算过程)
(3)加热时间t1后,9.68g剩余固体中除杂质外还含有的物质为_____________。
【题目】某校学习小组准备探究气体的测定和数据处理方法。
(提出问题)
如何利用石灰石(主要成分为CaCO3)与稀盐酸反应来测定生成CO2的质量和体积,并处理数据。
(实验设计)通过下列两个实验分别测定CO2的质量和体积:
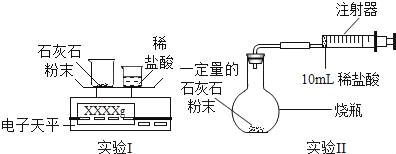
(分析与表达)
(1)上述两个实验中,反应的化学方程式是_____。
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中CaCO3完全反应的实验现象是_____。
(3)实验Ⅱ中,先连接好装置,再_____(填操作名称),然后装好药品,最后将10ml稀盐酸快速推入烧瓶中。若稀盐酸是缓慢推入的,则可能造成的后果是
_____。
(记录与处理)
(4)已知实验I反应前的总质量[m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是_____。
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
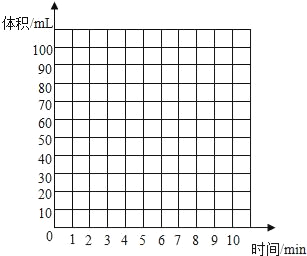
(5)实验Ⅱ的实验记录如下(表中数据在相同温度、相同压强条件下测定):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
①根据以上实验过程和数据综合分析,最终生成CO2的体积是_____mL,理由是_____。
②根据你的认识,在坐标图中绘制出0~10min生成CO2体积随时间变化的曲线。
(反思与评价)
(6)经过分析,你认为实验I/span>的优点是_____,实验Ⅱ的优点是_____。
【题目】同学们在实验室用下图装置制取氧气。
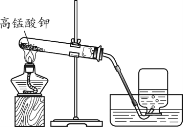
(1)加热高锰酸钾时,试管口略向下倾斜的原因是______。
实验后,同学们发现沾有高锰酸钾的白抹布洗完晾干后变为棕褐色。
(查阅资料)
草酸溶液能将棕褐色物质除去。
(提出问题)
哪些因素能加快草酸除去棕褐色物质的速率?
(进行实验)
将均匀染有棕褐色的抹布剪成大小相同的小布条进行实验
实验 编号 | 实验1
20℃ 水 | 实验2
20℃ 0.5%草酸溶液 | 实验3
20℃ 0.25%草酸溶液 | 实验4
20℃ 0.125%草酸溶液 | 实验5
30℃ 0.25%草酸溶液 | 实验6
40℃ 0.25%草酸溶液 |
现象 | 颜色 没有褪去 | 70秒后 颜色褪去 | 98秒后 颜色褪去 | 150秒后 颜色褪去 | 51秒后 颜色褪去 | 40秒后 颜色褪去 |
(解释与结论)
(2)配制200g溶质质量分数为 0.5%的草酸溶液,需要草酸的质量为______。
(3)实验1的目的是______。
(4)证明升高温度能加快草酸除去棕褐色物质的速率,需要对比______(填实验序号)。
(5)由实验2、3、4可以得出的结论是______。
(反思与评价)
(6)实验后,同学们查资料得知抹布上的棕褐色物质为二氧化锰,请你设计实验方案进行验证______。