题目内容
29、下表列出了1-18号元素的原子序数和元素符号:
请回答下列问题:
(1)l~18号元素中属于稀有气体元素的有He、Ne、
(2)l~18号元素中最外层有2个电子的原子有
(3)某元素的原子结构示意图为 ,它在化学反应中一般易
,它在化学反应中一般易
或“失去”),它与地壳中含量最多的金属元素形成化合物的化学式为
(4)某粒子的结构示意图为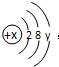 ,当x-y=8时,该粒子为
,当x-y=8时,该粒子为
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质.下列各组粒子中属于等电子体的是
A、NO和O2B、CO和N2C、SO2和CO2D、PO43-和SO42-.
| 原子序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 元素符号 | H | He | Li | Be | B | C | N | O | F |
| 原子序数 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 元素符号 | Ne | Na | Mg | Al | Si | P | S | Cl | Ar |
(1)l~18号元素中属于稀有气体元素的有He、Ne、
Ar
(填元素符号).(2)l~18号元素中最外层有2个电子的原子有
He
、Be、Mg(填元素符号).(3)某元素的原子结构示意图为
 ,它在化学反应中一般易
,它在化学反应中一般易得到
电子(填“得到”或“失去”),它与地壳中含量最多的金属元素形成化合物的化学式为
AlCl3
.(4)某粒子的结构示意图为
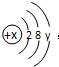 ,当x-y=8时,该粒子为
,当x-y=8时,该粒子为S2-
.(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质.下列各组粒子中属于等电子体的是
B、D
(填序号字母).A、NO和O2B、CO和N2C、SO2和CO2D、PO43-和SO42-.
分析:(1)要会写稀有气体的元素符号,前18号元素中稀有气体元素有:He、Ne、Ar;
(2)首先由原子结构示意图判断出是什么元素,再根据原子最外层有8个电子时稳定判断出最外层少于4个时容易失去电子、大于4个时容易得到电子;
(3)根据元素的原子结构判断该元素在化学反应中得失电子情况;记忆地壳中元素的含量的顺序;
(4)根据粒子结构示意图中的未知数来判断该粒子的写法;
(5)理解什么是等电子体,离子团所含电子数等于各离子的电子数之和.
(2)首先由原子结构示意图判断出是什么元素,再根据原子最外层有8个电子时稳定判断出最外层少于4个时容易失去电子、大于4个时容易得到电子;
(3)根据元素的原子结构判断该元素在化学反应中得失电子情况;记忆地壳中元素的含量的顺序;
(4)根据粒子结构示意图中的未知数来判断该粒子的写法;
(5)理解什么是等电子体,离子团所含电子数等于各离子的电子数之和.
解答:解:(1)此小题只要会写稀有气体元素符号,就可知1-18号元素中稀有气体元素有He、Ne、Ar,故此题答案为Ar;
(2)熟练掌握1-18号元素的原子结构示意图,可知其中最外层电子数为2的原子有He、Be、Mg,故此题答案为He;
(3)据图可知该元素为17号元素氯元素,氯原子最外层有7个电子,最外层电子数>4个,故易得到电子;地壳中含量前4位的是氧、硅、铝、铁,所以地壳中含量最多的金属元素是铝,故氯元素和铝元素形成的化合物的化学式AlCl3;
(4)由该粒子的结构示意图中,x-y=8可得:x=8+y,而y是最外层电子数,取值范围是1-8,通过带入可得y=8,x=16,所以为16号元素硫,但核外有18个电子,不是硫原子而是硫离子.故该粒子是S2-;
(5)理解等电子体是具有相同原子数和电子数的分子或离子.
A、一个NO分子中有2个原子,7+8=15个电子;一个O2分子中有2个原子,8+8=16个电子,所以A中两种分子不是等电子体;
B、一个CO分子中有2个原子,6+8=14个电子;一个N2分子中有2个原子,7+7=14个电子,所以B中两种分子是等电子体;
C、一个SO2分子中有3个原子,16+8×2=32个电子;一个CO2分子中有3个原子,6+8×2=22个电子,所以C中两种分子不是等电子体;
D、一个PO43-离子中有4个原子,15+8×4+3=50个电子;一个SO42-离子中有4个原子,16+8×4+2=50个电子,所以D中两种离子是等电子体.
故选B、D
(2)熟练掌握1-18号元素的原子结构示意图,可知其中最外层电子数为2的原子有He、Be、Mg,故此题答案为He;
(3)据图可知该元素为17号元素氯元素,氯原子最外层有7个电子,最外层电子数>4个,故易得到电子;地壳中含量前4位的是氧、硅、铝、铁,所以地壳中含量最多的金属元素是铝,故氯元素和铝元素形成的化合物的化学式AlCl3;
(4)由该粒子的结构示意图中,x-y=8可得:x=8+y,而y是最外层电子数,取值范围是1-8,通过带入可得y=8,x=16,所以为16号元素硫,但核外有18个电子,不是硫原子而是硫离子.故该粒子是S2-;
(5)理解等电子体是具有相同原子数和电子数的分子或离子.
A、一个NO分子中有2个原子,7+8=15个电子;一个O2分子中有2个原子,8+8=16个电子,所以A中两种分子不是等电子体;
B、一个CO分子中有2个原子,6+8=14个电子;一个N2分子中有2个原子,7+7=14个电子,所以B中两种分子是等电子体;
C、一个SO2分子中有3个原子,16+8×2=32个电子;一个CO2分子中有3个原子,6+8×2=22个电子,所以C中两种分子不是等电子体;
D、一个PO43-离子中有4个原子,15+8×4+3=50个电子;一个SO42-离子中有4个原子,16+8×4+2=50个电子,所以D中两种离子是等电子体.
故选B、D
点评:A此题考查的是原子结构示意图的意义,稀有气体元素,地壳中元素含量,另外第(5)小题是给出信息题,先给出等电子体的概念,然后再来做出选择.其中前三个小题比较简单,属于基础题;后两个小题较难一点.

练习册系列答案
相关题目
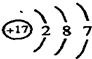 ,它在化学反应中一般易
,它在化学反应中一般易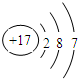 ,它代表的粒子符号
,它代表的粒子符号 ,当x-y=8时,该粒子符号为
,当x-y=8时,该粒子符号为 下表列出了1-18号元素的原子序数和元素符号:
下表列出了1-18号元素的原子序数和元素符号: ,它在化学反应中一般易
,它在化学反应中一般易