题目内容
 下表列出了1-18号元素的原子序数和元素符号:
下表列出了1-18号元素的原子序数和元素符号:| 原子序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 元素符号 | H | He | Li | Be | B | C | N | O | F |
| 原子序数 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 元素符号 | Ne | Na | Mg | Al | Si | P | S | Cl | Ar |
(1)1一18号元素中属于稀有气体元素的有He、Ne、
Ar
Ar
(填元素符号).(2)10一18号元素中属于金属元素的有
5
5
种.(3)如图为某粒子的结构示意图,当x与y满足
x=10+y
x=10+y
的条件时,该粒子为原子.(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质.下列各组粒子中属于等电子体的是
B
B
(填字母序号).A.NO和O2 B.CO和N2 C.SO2和CO2 D.Na+和OH-.
分析:(1)依据常见的稀有气体种类分析解答;
(2)依据金属元素的汉子特点是含有“钅”的元素分析解答;
(3)依据原子中质子数等于核外电子数分析解答;
(4)根据题目信息,具有相同原子数和电子数的分子或离子叫等电子体,而后利用分子中质子数等于电子数分析判断即可;
(2)依据金属元素的汉子特点是含有“钅”的元素分析解答;
(3)依据原子中质子数等于核外电子数分析解答;
(4)根据题目信息,具有相同原子数和电子数的分子或离子叫等电子体,而后利用分子中质子数等于电子数分析判断即可;
解答:解:(1)常见的稀有气体由氦、氖、氩等气体,分析表格内的元素情况可知除He、Ne外还有Ar也是稀有气体元素;
(2)依据金属元素的汉子特点是含有“钅”的元素,所以1-18号元素中含有的金属元素是锂、铍、钠、镁和铝五种;
(3)在原子中质子数等于核外的电子数,故该粒子为原子时x=10+y;
(4)A、NO的质子数为7+8=15,O2的质子数为8×2=16,分子中质子数等于电子数,所以两者的电子数不相等,不是等电子体;
B、CO的质子数为6+8=14,N2的质子数为7×2=14,分子中质子数等于电子数,且两者的分子中含有的原子个数都是2,所以两者是等电子体;
C、CO2的质子数为6+8×2=22,SO2的质子数为16+8×2=32,分子中质子数等于电子数,所以两者的电子数不相等,不是等电子体;
D、Na+和OH-两者的微粒中原子的个数不相等,故不是等电子体;
故答案为:(1)Ar;(2)5;(3)x=10+y;(4)B;
(2)依据金属元素的汉子特点是含有“钅”的元素,所以1-18号元素中含有的金属元素是锂、铍、钠、镁和铝五种;
(3)在原子中质子数等于核外的电子数,故该粒子为原子时x=10+y;
(4)A、NO的质子数为7+8=15,O2的质子数为8×2=16,分子中质子数等于电子数,所以两者的电子数不相等,不是等电子体;
B、CO的质子数为6+8=14,N2的质子数为7×2=14,分子中质子数等于电子数,且两者的分子中含有的原子个数都是2,所以两者是等电子体;
C、CO2的质子数为6+8×2=22,SO2的质子数为16+8×2=32,分子中质子数等于电子数,所以两者的电子数不相等,不是等电子体;
D、Na+和OH-两者的微粒中原子的个数不相等,故不是等电子体;
故答案为:(1)Ar;(2)5;(3)x=10+y;(4)B;
点评:本题难度不大,考查学生灵活运用元素周期表中元素的信息、辨别元素种类的方法、利用信息进行处理等进行分析解题的能力.

练习册系列答案
相关题目
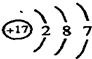 ,它在化学反应中一般易
,它在化学反应中一般易 ,它在化学反应中一般易
,它在化学反应中一般易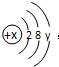 ,当x-y=8时,该粒子为
,当x-y=8时,该粒子为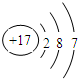 ,它代表的粒子符号
,它代表的粒子符号 ,当x-y=8时,该粒子符号为
,当x-y=8时,该粒子符号为 ,它在化学反应中一般易
,它在化学反应中一般易