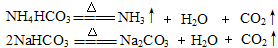题目内容
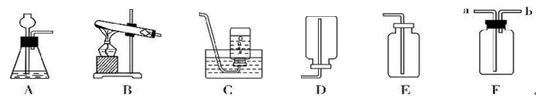
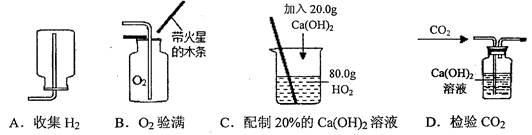
(10分)以下是实验室常用的气体制备、收集的装置。

(1)若实验室用A装置制取氧气,其化学方程式为 。
(2)若用C装置来收集CO2气体,则检验CO2已收满的方法是 。
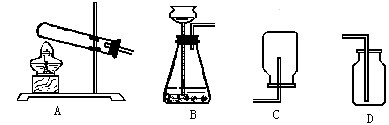
(3)若实验室用锌粒和稀硫酸制取氢气,反应的化学方程式为 ,可选择的发生装置是 。若用E、F装置进行组合来收集并测定氢气的体积,则氢气应从E装置的 (填“g”或“h”)导管口进,仪器F的名称是 。
(4)对锌与稀硫酸反应快慢的影响因素进行探究。反应过程中,利用前10min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下:
①比较实验a和实验b,可以得到的结论是 。
②要比较不同溶质质量分数的硫酸对反应快慢的影响,应选择的是 (填实验编号)。

(1)若实验室用A装置制取氧气,其化学方程式为 。
(2)若用C装置来收集CO2气体,则检验CO2已收满的方法是 。
(3)若实验室用锌粒和稀硫酸制取氢气,反应的化学方程式为 ,可选择的发生装置是 。若用E、F装置进行组合来收集并测定氢气的体积,则氢气应从E装置的 (填“g”或“h”)导管口进,仪器F的名称是 。
(4)对锌与稀硫酸反应快慢的影响因素进行探究。反应过程中,利用前10min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下:
| 实验编号 | 试剂 | 前 10 min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和溶质质量分数的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
②要比较不同溶质质量分数的硫酸对反应快慢的影响,应选择的是 (填实验编号)。
(1)2KClO3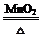 2KCl + 3O2 ↑或2KMnO4
2KCl + 3O2 ↑或2KMnO4  K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
(2)燃着的木条放在集气瓶口熄灭。 (3)Zn + H2SO4 =ZnSO4+H2↑ B h 量筒;(4)①与同体积同溶质质量分数的稀硫酸反应,含杂质的锌比纯锌反应速率更快。②ac
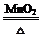 2KCl + 3O2 ↑或2KMnO4
2KCl + 3O2 ↑或2KMnO4  K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑(2)燃着的木条放在集气瓶口熄灭。 (3)Zn + H2SO4 =ZnSO4+H2↑ B h 量筒;(4)①与同体积同溶质质量分数的稀硫酸反应,含杂质的锌比纯锌反应速率更快。②ac
试题分析:(1)若实验室用A装置制取氧气,因为固体加热制取气体,故其化学方程式为2KClO3
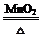 2KCl + 3O2 ↑或2KMnO4
2KCl + 3O2 ↑或2KMnO4  K2MnO4 + MnO2 + O2↑;(2)若用C装置来收集CO2气体,则检验CO2已收满的方法是燃着的木条放在集气瓶口熄灭;(3)若实验室用锌粒和稀硫酸制取氢气,反应的化学方程式为Zn + H2SO4 =ZnSO4+H2↑ ,因为是固液常温下反应,故可选择的发生装置是B,若用E、F装置进行组合来收集并测定氢气的体积,故气体要从装置的短管进,则氢气应从E装置的 h,导管口进,仪器F的名称是;量筒;(4)对锌与稀硫酸反应快慢的影响因素进行探究①比较实验a和实验b,可以得到的结论是与同体积同溶质质量分数的稀硫酸反应,含杂质的锌比纯锌反应速率更快;②要比较不同溶质质量分数的硫酸对反应快慢的影响,应选择的是ac,控制变量。
K2MnO4 + MnO2 + O2↑;(2)若用C装置来收集CO2气体,则检验CO2已收满的方法是燃着的木条放在集气瓶口熄灭;(3)若实验室用锌粒和稀硫酸制取氢气,反应的化学方程式为Zn + H2SO4 =ZnSO4+H2↑ ,因为是固液常温下反应,故可选择的发生装置是B,若用E、F装置进行组合来收集并测定氢气的体积,故气体要从装置的短管进,则氢气应从E装置的 h,导管口进,仪器F的名称是;量筒;(4)对锌与稀硫酸反应快慢的影响因素进行探究①比较实验a和实验b,可以得到的结论是与同体积同溶质质量分数的稀硫酸反应,含杂质的锌比纯锌反应速率更快;②要比较不同溶质质量分数的硫酸对反应快慢的影响,应选择的是ac,控制变量。
练习册系列答案
相关题目