题目内容
【题目】某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。此时,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质的成分进行探究。
(1)写出该中和反应的化学方程式。
(2)探究烧杯内溶液中溶质的成分:
【提出问题】
该烧杯内的溶液中溶质是什么?
【进行猜想】
(A)溶质可能是CaCl2与Ca(OH)2
(B)溶质可能只是CaCl2
(C)溶质可能是CaCl2与盐酸
【实验探究】
①小明从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液.振荡.观察到酚酞试液不变色。于是他排除了猜想(A),你认为他排除猜想(A)的理由是。
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格: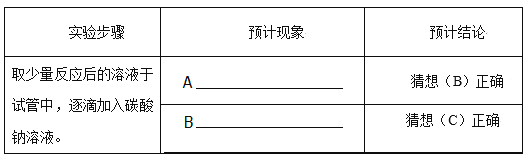
A: ;B:
通过以上探究,最后确定猜想(C)正确。
【反思与拓展】
你认为上述烧杯内溶液如果未经处理直接倒入铁制下水道,可能造成的危害是 。要想处理烧杯内溶液使其只得到CaCl2溶液,应向溶液中加入过量 ,充分反应后过滤,反应的方程式为 。
【答案】
(1)Ca(OH)2 + 2HCl = CaCl2 + 2H2O
(2)酚酞溶液不变色,说明溶液不呈碱性,而猜想②的溶液呈碱性,所以可以排除. (其他说法合理也给分)。;只有白色沉淀产生;先有气泡产生,后有白色沉淀产生;腐蚀下水道;CaCO3;CaCO3+2HCl ![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
【解析】(1)方程式:Ca(OH)2 + 2HCl = CaCl2 + 2H2O ;氢氧化钙是碱可以使无色酚酞变为红色,加分太不变色故(A)错误。(2)(B)CaCl2 和碳酸钠反应生成碳酸钙沉淀;(C)CaCl2与盐酸,盐酸和碳酸钠生成二氧化碳,会看到气泡,当盐酸没有了后,CaCl2 和碳酸钠反应生成碳酸钙沉淀;
【反思与拓展】盐酸具有强腐蚀性,会造成水污染,可以加入碳酸钙反应除去盐酸,原理CaCO3+2HCl ![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
【考点精析】掌握中和反应及其应用是解答本题的根本,需要知道中和反应:酸与碱作用生成盐和水的反应.