题目内容
【题目】根据下图回答问题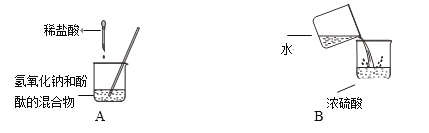
(1)实验A中能观察到的现象是 , 化学方程式为
(2)实验B造成的后果是
【答案】
(1)溶液由红色变为无色(或红色消失);NaOH+HCl==NaCl+H2O
(2)液体沸腾而飞溅(沸腾或飞溅都可以)
【解析】(1)氢氧化钠溶液显碱性,酚酞遇碱变红色,所以A中滴加稀盐酸前溶液为红色;随着盐酸的加入,酸碱不断中和生成中性的NaCl溶液,当酸碱恰好中和时溶液呈中性,继续滴加则呈酸性,而酚酞试液在中性、酸性溶液中均呈无色,故可观察到的现象是溶液由红色逐渐变为无色;发生反应的化学方程式为NaOH+HCl=NaCl+H2O。(2)稀释浓硫酸时,应将浓硫酸沿烧杯内壁慢慢倒入水中,并不断搅拌。若倾倒顺序相反,因为浓硫酸遇水放热且水的密度小于浓硫酸,在刚加入水时浓硫酸溶解放出的热量使水沸腾、液滴飞溅,易对实验者造成危险。
熟记酸碱指示剂与酸、碱时的颜色变化,判断酸与碱的存在,稀释浓硫酸一定记住酸入水,玻璃棒不断搅拌。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
【题目】近段时间,我国猪内价格上涨幅度已超过50%,猪肉价格的不断上涨对国民的生活带来了一定的负面影响.猪肉的新鲜度可以通过测试pH来判断.有资料显示,pH与肉类新鲜度的关系为:
名称 | 新鲜肉 | 次鲜肉 | 变质肉 |
pH | 5.8~6.2 | 6.3~6.6 | >6.7 |
新鲜肉在变质过程中酸性强弱的变化为( )
A.变强
B.变弱
C.不变
D.无法确定