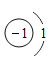题目内容
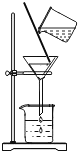
【题目】有一包白色固体样品,可能由Na2SO4、NaOH、CaCO3、BaCl2、MgCl2、KNO3中的一种或几种物质组成。取样品少量于试管中,加入足量的蒸馏水充分溶解后过滤,向滤渣中加入足量盐酸,充分反应后,滤渣全部溶解,同时有无色气体生成;向滤液中通入适量CO2气体,有白色沉淀生成。根据实验现象回答下列问题:
(1)固体样品中一定含有_________;一定不含________;可能含有_________。
(2)写出滤液中通入CO2发生反应的化学方程式________。
【答案】CaCO3、NaOH、BaCl2 Na2SO4 KNO3、MgCl2 ![]() 、
、![]()
【解析】
取样品少量于试管中,加入足量的蒸馏水充分溶解后过滤,向滤渣中加入足量盐酸,充分反应后,滤渣全部溶解,同时有无色气体生成,则固体样品一定含有CaCO3,向滤液中通入适量CO2气体,有白色沉淀生成,则滤液中有NaOH和BaCl2,二氧化碳与氢氧化钠生成碳酸钠,碳酸钠再与氯化钡反应生成碳酸钡白色沉淀,所以固体样品中还一定含有NaOH和BaCl2;根据滤渣加盐酸全部溶解,滤液有BaCl2,则固体样品就一定没有Na2SO4,因为硫酸钡不溶于盐酸。在该实验过程中无法证明固体样品是否含有KNO3,而MgCl2虽然与氢氧化钠反应,但生成的氢氧化镁沉淀溶于盐酸,如果固体样品MgCl2的量比较少,不足以消耗完氢氧化钠,对结果无影响,所以固体样品可能含有KNO3和MgCl2。
(1)固体样品中一定含有CaCO3、NaOH和BaCl2;一定不含Na2SO4;可能含有KNO3和MgCl2。
(2)滤液中通入CO2产生白色沉淀,发生的反应化学方程式有![]() 和
和![]() 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】为了测定实验室中KClO3样品的纯度,某学习小组取2.5g该样品与0.5gMnO2混合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录数据如下表所示。
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 2.48 | 2.34 | 2.04 | 2.04 |
请仔细分析实验数据,回答下列问题:
(1)在_____________时间后,该样品中的KClO3已经完全反应。
(2)完全反应后产生O2的质量是_______________。
(3)该样品中KClO3的质量是______。