题目内容
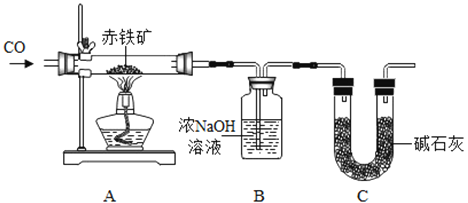
【题目】如图所示: (1) 第一组的同学以大理石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,连接顺序为A→C→B→F,回答下列问题:

①写出A中的反应方程式____________;
②指出图中装置F的错误________________;
③C中NaHCO3溶液的作用是除掉CO2中混有少量HCl气体,B中浓H2SO4的作用是_____________;
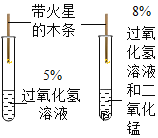
(2)为探究某种塑料试样的元素含量(资料显示该塑料只含C,H,O三种元素),第二组的同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,并让该塑料试样在制备的氧气中燃烧,所选仪器按“A→B1→E→B2→D”的顺序连接(B1,B2 为浓硫酸洗气瓶),观察现象,收集有关实验数据(假设发生的化学反应都充分反应),试回答下列问题:
①仪器A中所发生反应的化学方程式为:___________;
②仪器E的玻璃管中放入的塑料试样碎屑质量为mg,塑料试样充分燃烧后,测得仪器D质量增加ag,则mg该塑料试样中含碳元素的质量为_____________g (计算结果可为分数形式)。
【答案】![]() 导管末端未深入集气瓶底 干燥二氧化碳气体
导管末端未深入集气瓶底 干燥二氧化碳气体 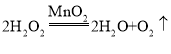
![]()
【解析】
(1)①A中大理石和稀盐酸反应生成二氧化碳、氯化钙、水,方程式为![]() ;
;
②图中装置F的错误是导管末端未伸入集气瓶底,导致收集气体不纯;
③C中NaHCO3溶液的作用是除掉CO2中混有少量HCl气体,碳酸氢钠和氯化氢反应生成氯化钠、二氧化碳、水,B中浓H2SO4的作用是干燥二氧化碳;
(2)①仪器A中所发生反应是过氧化氢在二氧化锰的作用下分解生成氧气,化学方程式为: 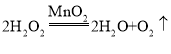 ;
;
②仪器E的玻璃管中放入的塑料试样碎屑质量为mg,塑料试样充分燃烧后,测得仪器D质量增加ag,D中增加的质量为吸收二氧化碳的质量,即塑料燃烧产生二氧化碳的质量,据质量守恒定律可知反应前后元素的种类、质量不变,则mg该塑料试样中含碳元素的质量等于生成二氧化碳中碳元素的质量,为a![]() g=
g=![]() g。
g。

【题目】下列实验方案与实验结论相对应的是
选项 | A | B | C | D |
方案 |
|
|
|
|
结论 | 研究二氧化锰的催化作用 | 测定空气中氧气的含量 | 说明氨分子在不断地运动 | 反应前锥形瓶内红磷和氧气的总质量一定等于反应后生成五氧化二磷的质量 |
A.AB.BC.CD.D
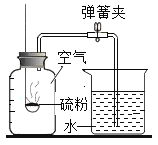
【题目】如图所示,把足量的硫粉放入氧气中充分燃烧。
(1)硫在氧气中燃烧的化学方程式是___________________________。
(2)实验后,取少量集气瓶内的溶液于试管中,再往试管中滴加数滴的紫色石蕊溶液,振荡。发现紫色石蕊溶液变成红色。(提示:石蕊溶液是将石蕊加入水中溶解后得到的混合物)
[提出问题]是什么物质使紫色石蕊变红色呢?
[提出假设]假设1:水使紫色石蕊变红;
假设2:__________________使紫色石蕊变红;
假设3:二氧化硫与水反应的生成物使紫色石蕊变红。
[设计实验]
①我们可判断假设________________不成立,因为石蕊溶液中含有这种物质,不能使紫色变红。
②请设计一个实验方案验证另外两个假设是否成立,用文字描述实验步骤及填写预期实验现象和结论。(提供的试剂和用品有:干燥的紫色石蕊纸花若干朵、干燥的二氧化硫两瓶、水)
实验步骤 | 预期实验现象和结论 |
将干燥的紫色石蕊纸花,放入盛有______________瓶中。 | _________________,假设2不成立。 |
将干燥的紫色石蕊纸花_______________后放入盛有干燥的二氧化硫的瓶中。 | ________________________,假设______________成立。 |