题目内容
(1)实验室常用过氧化氢与二氧化锰来制取氧气,该反应中二氧化锰的作用是______.
(2)实验室也可用高锰酸钾来制取氧气.某同学想用实验来证明高锰酸钾溶液的紫红色是MnO4-的颜色,而不是K+的颜色,他设计的下列实验步骤中没有意义的是______.
①将高锰酸钾晶体加热分解,所得固体质量减少
②观察氯化钾溶液没有颜色,表明溶液中K+无色
③在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应
④在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-为紫红色
(3)过氧化钠与水的反应也能用来制取氧气:
Na2O2+2H2O=2NaOH+H2O2 ;2H2O2=2H2O+O2↑
已知:当NaOH溶液的质量分数大于24%时,酚酞显无色;H2O2具有漂白性,能使有色有机物氧化褪色.现将0.39g Na2O2溶解在10.0mL过量水中,再向所得溶液中滴入2滴酚酞,溶液先变红,片刻后红色褪去.据此回答下列问题:
①甲同学认为红色褪去的原因是由于溶液中NaOH的质量分数过大,此种说法______(填“正确”或“不正确”).请通过计算加以说明.(假设过氧化氢完全分解;水的密度为1g/cm3)
②乙同学认为红色褪去的原因是由于反应后的溶液中有过氧化氢存在.请设计实验加以证明.
(1)因在实验室用过氧化氢与二氧化锰制取氧气时,二氧化锰是催化剂.
故答案为:催化作用
(2)要证明高锰酸钾溶液的紫红色是MnO4-的颜色,而不是K+的颜色,就要在溶液中进行实验,而①始终是固体,故没有意义.
氯化钾溶液中有K+,但没有颜色,故表明溶液中K+无色,②有意义.
③的目的是为④创造条件,③中说明锌与K+不反应,④中加入锌粉褪色,说明不是K+作用,运用了排除法.故③④都有意义.
故答案为:①
(3)①解:设 将0.39gNa2O2溶解在10.0mL过量水中,生成NaOH的质量为X,O2的质量为Y
写 2Na2O2 +2H2O=4NaOH+O2↑
找 156 160 32
0.39g X Y
列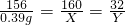
解 解得:X=0.40 g Y=0.08 g
则氢氧化钠的质量分数为: 100%≈3.9%
100%≈3.9%
因3.9%<24%,故红色褪去是由于NaOH的质量分数过大引起的说法是不正确的.
故答案为:不正确.
②证明过氧化氢存在,可联想实验室制取氧气的原理,2H2O2 2H2O+O2↑.
2H2O+O2↑.
也可从题目所给的信息出发,氢氧化钠溶液呈碱性,能使石蕊变蓝色,而石蕊试液本身是紫色,若加入紫色石蕊试液也褪色,那就说明是过氧化氢的作用.
故答案为:(答案一) 取反应后的溶液少量于试管中,加入少量MnO2粉末,然后把带火星的木条伸入试管中,若木条复燃,说明溶液中含有过氧化氢,红色褪去的原因是由于反应后的溶液中有过氧化氢存在.若木条不复燃,说明溶液中不含有过氧化氢,红色褪去的原因就不是由于过氧化氢存在引起的.
(答案二) 取反应后的溶液少量于试管中,加入少量紫色石蕊试液,若看到溶液由紫色先变蓝色,然后褪色,说明褪色的原因是由于反应后的溶液中有过氧化氢存在.若看到溶液变蓝后不退色,就说明褪色的原因不是由于过氧化氢存在引起的.
分析:(1)在实验室用过氧化氢与二氧化锰来制取氧气时,二氧化锰是催化剂,起的作用是催化作用.
(2)要证明高锰酸钾溶液的紫红色是MnO4-的颜色,而不是K+的颜色,就要在溶液中实验,而①是固体反应,故没有意义.若加热高锰酸钾晶体完全分解后,把剩余物溶于水,观察颜色的不同,就可以了.
(3)要判断是否是由于溶液中NaOH的质量分数过大,而引起的颜色变化,只要计算出反应后氢氧化钠的质量分数,看是否大于24%即可.已知过氧化钠的质量,氢氧化钠的质量很容易计算,而氢氧化钠溶液的质量,需要注意反应过程中逸出了氧气,应为加入的总质量减去氧气的质量.
要判断是否是由于反应后的溶液中有过氧化氢存在,而引起颜色的变化,只要证明溶液中有过氧化氢即可.根据所学知识,向溶液中加入二氧化锰,看是否产生氧气即可.
也可从题目所给的信息:当NaOH溶液的质量分数大于24%时,酚酞显无色;H2O2具有漂白性,能使有色有机物氧化褪色来考虑,氢氧化钠溶液呈碱性,能使石蕊变蓝色,而石蕊试液本身是紫色,若加入紫色石蕊试液也褪色,那就说明是过氧化氢的作用.
点评:该题属于信息题,主要考查同学们的分析问题的能力和语言表达能力.有关计算,尤其主要反应后溶液的溶质质量分数的计算,是易错点.
故答案为:催化作用
(2)要证明高锰酸钾溶液的紫红色是MnO4-的颜色,而不是K+的颜色,就要在溶液中进行实验,而①始终是固体,故没有意义.
氯化钾溶液中有K+,但没有颜色,故表明溶液中K+无色,②有意义.
③的目的是为④创造条件,③中说明锌与K+不反应,④中加入锌粉褪色,说明不是K+作用,运用了排除法.故③④都有意义.
故答案为:①
(3)①解:设 将0.39gNa2O2溶解在10.0mL过量水中,生成NaOH的质量为X,O2的质量为Y
写 2Na2O2 +2H2O=4NaOH+O2↑
找 156 160 32
0.39g X Y
列
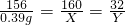
解 解得:X=0.40 g Y=0.08 g
则氢氧化钠的质量分数为:
 100%≈3.9%
100%≈3.9%因3.9%<24%,故红色褪去是由于NaOH的质量分数过大引起的说法是不正确的.
故答案为:不正确.
②证明过氧化氢存在,可联想实验室制取氧气的原理,2H2O2
 2H2O+O2↑.
2H2O+O2↑.也可从题目所给的信息出发,氢氧化钠溶液呈碱性,能使石蕊变蓝色,而石蕊试液本身是紫色,若加入紫色石蕊试液也褪色,那就说明是过氧化氢的作用.
故答案为:(答案一) 取反应后的溶液少量于试管中,加入少量MnO2粉末,然后把带火星的木条伸入试管中,若木条复燃,说明溶液中含有过氧化氢,红色褪去的原因是由于反应后的溶液中有过氧化氢存在.若木条不复燃,说明溶液中不含有过氧化氢,红色褪去的原因就不是由于过氧化氢存在引起的.
(答案二) 取反应后的溶液少量于试管中,加入少量紫色石蕊试液,若看到溶液由紫色先变蓝色,然后褪色,说明褪色的原因是由于反应后的溶液中有过氧化氢存在.若看到溶液变蓝后不退色,就说明褪色的原因不是由于过氧化氢存在引起的.
分析:(1)在实验室用过氧化氢与二氧化锰来制取氧气时,二氧化锰是催化剂,起的作用是催化作用.
(2)要证明高锰酸钾溶液的紫红色是MnO4-的颜色,而不是K+的颜色,就要在溶液中实验,而①是固体反应,故没有意义.若加热高锰酸钾晶体完全分解后,把剩余物溶于水,观察颜色的不同,就可以了.
(3)要判断是否是由于溶液中NaOH的质量分数过大,而引起的颜色变化,只要计算出反应后氢氧化钠的质量分数,看是否大于24%即可.已知过氧化钠的质量,氢氧化钠的质量很容易计算,而氢氧化钠溶液的质量,需要注意反应过程中逸出了氧气,应为加入的总质量减去氧气的质量.
要判断是否是由于反应后的溶液中有过氧化氢存在,而引起颜色的变化,只要证明溶液中有过氧化氢即可.根据所学知识,向溶液中加入二氧化锰,看是否产生氧气即可.
也可从题目所给的信息:当NaOH溶液的质量分数大于24%时,酚酞显无色;H2O2具有漂白性,能使有色有机物氧化褪色来考虑,氢氧化钠溶液呈碱性,能使石蕊变蓝色,而石蕊试液本身是紫色,若加入紫色石蕊试液也褪色,那就说明是过氧化氢的作用.
点评:该题属于信息题,主要考查同学们的分析问题的能力和语言表达能力.有关计算,尤其主要反应后溶液的溶质质量分数的计算,是易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.为了探究其反应原理,兴趣小组同学在老师的指导下,进行了如下探究,请你一起参与.
[查阅资料]过氧化钠在常温下与水、二氧化碳反应分别生成氢氧化钠、碳酸钠和氧气.
[设计实验]浩明同学想通过下图所示装置探究过氧化钠与二氧化碳的反应,并验证反应产物.
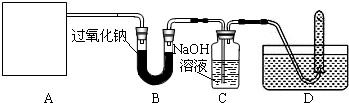
(1)下列是实验室常用的仪器:
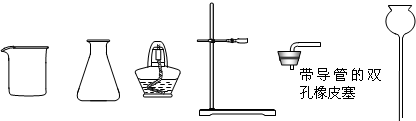
①A是二氧化碳气体的发生装置,装配该装置时,应选用的仪器除带导管的双孔橡皮塞外,还需要的仪器有(填名称) 、 .实验室制取二氧化碳的化学方程式 .该装置在实验室还可以用来制取氧气,写出用该装置制取氧气的化学方程式 2H2O2
2H2O+O2↑.
②实验室选择制取气体的发生装置,主要依据是 、 .
(2)用D所示的方法收集氧气,其依据是 ;收集氧气时,还可以选用 法收集.检验D装置试管内收集到中的气体是否氧气的方法、现象及结论是:待D中气体集满后,把试管移出水面,然后 .
(3)C中氢氧化钠的作用是吸收没有参与反应的CO2,如果没有连接这个装置,可能导致的后果是 .
(4)检验B中反应后剩余固体的成分.
[反思与评价](1)通过上述实验,明明同学认为Na2O2与CO2反应除了生成Na2CO3和O2,还有可能生成NaHCO3.你认为他的结论 (选填“正确”或“不正确”),理由是 .写出Na2O2与二氧化碳反应的化学方程式 .
(2)请说说呼吸面具或潜水艇用过氧化钠作为供氧剂的最大的是优点 .
[查阅资料]过氧化钠在常温下与水、二氧化碳反应分别生成氢氧化钠、碳酸钠和氧气.
[设计实验]浩明同学想通过下图所示装置探究过氧化钠与二氧化碳的反应,并验证反应产物.

(1)下列是实验室常用的仪器:

①A是二氧化碳气体的发生装置,装配该装置时,应选用的仪器除带导管的双孔橡皮塞外,还需要的仪器有(填名称)
| ||
②实验室选择制取气体的发生装置,主要依据是
(2)用D所示的方法收集氧气,其依据是
(3)C中氢氧化钠的作用是吸收没有参与反应的CO2,如果没有连接这个装置,可能导致的后果是
(4)检验B中反应后剩余固体的成分.
| 实验步骤 | 实验现象 | 实验结论及方程式 |
| ①取少量A中反应后的固体于试管中; ② ③ |
② ③ |
反应后生成的固体是碳酸钠,写出步骤③的方程式 |
(2)请说说呼吸面具或潜水艇用过氧化钠作为供氧剂的最大的是优点