题目内容
【题目】如图是实验室模拟工业炼铁的装置图.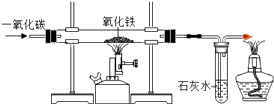
(1).分别写出硬质玻璃管内产生的现象反应的化学方程式
(2)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是。
(3)高炉炼铁中,焦炭的两个作用是(用化学方程式表示)。
(4)用含氧化铁80%的赤铁矿200t,可炼制含杂质2%的生铁吨
(5)某合金6 g与足量的稀硫酸充分反应后,如果生成0.2 g氢气,该合金中的金属可能是
A.Zn 和Fe
B.Cu和Ag
C.Zn和Cu
D.Mg 和Al
【答案】
(1)红色粉末变成黑色,Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(2)在右端导气管口用排水法收集一试管气体,移近火焰,若发出轻微的爆鸣声,证明空气已经排尽
(3)2C+O2 ![]() 2CO,2C+CO2
2CO,2C+CO2 ![]() 2CO
2CO
(4)114.3
(5)A
【解析】(1).硬质玻璃管内产生的现象是红色粉末变成黑色,反应的化学方程式是Fe2O3+3CO ![]() 2Fe+3CO2。
2Fe+3CO2。
(2)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是在右端导气管口用排水法收集一试管气体,移近火焰,若发出轻微的爆鸣声,证明空气已经排尽。
(3)高炉炼铁中,焦炭的两个作用是:2C+O2 ![]() 2CO,2C+CO2
2CO,2C+CO2 ![]() 2CO。
2CO。
(4)用含氧化铁80%的赤铁矿200t,可炼制含杂质2%的生铁∶
Fe2O3+3CO | 2Fe+3CO2 |
160 | 112 |
80%×200t | x×98% |
![]() =
= ![]()
,x=114.3t。
(5)A、锌的相对原子质量是65,铁的相对原子质量是56,根据Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4═FeSO4+H2↑,可知,如果生成0.2g氢气时,单独消耗锌的质量是6.5g,单独消耗铁的质量是5.6g,如果铁和锌按照一定的比例组合成6g时,生成的氢气可能是0.2g,故选项正确;
B、铜和银都不能与稀硫酸反应.故选项错误;
C、铜不能与稀硫酸反应,假设合金6g中全部是锌,生成的氢气质量也小于0.2g.故选项错误;
D、镁的相对原子质量是24,铝的相对原子质量是27,由Mg+H2SO4═MgSO4+H2↑,2Al+3H2SO4═Al2(SO4)3+3H2↑,可知,如果生成0.2g氢气时,单独消耗镁的质量是2.4g,单独消耗铝的质量是1.8g,镁和铝不管以怎样的比例混合,生成氢气的质量都是大于0.2g的,选项错误。
所以答案是:A
【考点精析】根据题目的已知条件,利用金属材料的选择依据和一氧化碳还原氧化铁的相关知识可以得到问题的答案,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案