题目内容
酸碱中和反应在工农业生产和科研上具有很大用途.
(1)若中和反应需要60g 10%的NaOH溶液,现提供50g 20%的NaOH溶液、40g 5%的NaOH溶液以及足够的NaOH固体和水,请选用以上提供的药品设计两种配制方案(只要说明配制所需的各种药品用量)填入下表中.
(2)如图是某学生用氢氧化钠固体和水配制60g 10% NaOH溶液的部分操作过程,该同学在称量氢氧化钠时,先在两个托盘上各放一张质量相同的纸,然后把药品直接放在纸上称量.
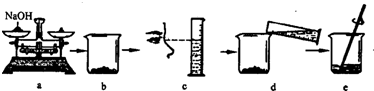
①a操作中的错误是
②下列操作中导致溶质质量分数偏低的是
A.a操作中砝码和氢氧化钠放错盘 B.b中烧杯用水洗涤后未干燥就使用
C.c操作中平视量筒凹液面最低处读数为50mL D.d操作中有少量水溅出.
(1)若中和反应需要60g 10%的NaOH溶液,现提供50g 20%的NaOH溶液、40g 5%的NaOH溶液以及足够的NaOH固体和水,请选用以上提供的药品设计两种配制方案(只要说明配制所需的各种药品用量)填入下表中.
| 序 号 | 配制方案 |
| 举例 | 6g NaOH固体和54g水 |
| 方案1 | 30g20%的NaOH溶液和30g水 30g20%的NaOH溶液和30g水 |
| 方案2 | 40g 5%的NaOH溶液、4gNaOH固体和16g水 40g 5%的NaOH溶液、4gNaOH固体和16g水 |

①a操作中的错误是
氢氧化钠直接放在纸上称量
氢氧化钠直接放在纸上称量
.②下列操作中导致溶质质量分数偏低的是
AB
AB
(填字母).A.a操作中砝码和氢氧化钠放错盘 B.b中烧杯用水洗涤后未干燥就使用
C.c操作中平视量筒凹液面最低处读数为50mL D.d操作中有少量水溅出.
分析:(1)配制60g 10%的NaOH溶液,只需要取足氢氧化钠60g×10%=6g,然后加入适量水使得溶液质量达到60g即可完成所需要溶液的配制.
(1)①称量药品时,有腐蚀性的药品要放在玻璃器皿上称量,据此回答;
②依据溶质质量分数的计算公式:溶质质量分数=
×100%进行分析,导致溶质质量分数偏大有两大因素:溶质质量偏大、溶剂质量偏小.然后针对每个选项进行分析,判断该操作对溶质、溶剂有何影响,最后得出答案.
(1)①称量药品时,有腐蚀性的药品要放在玻璃器皿上称量,据此回答;
②依据溶质质量分数的计算公式:溶质质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)配制60g 10%的NaOH溶液,需要氢氧化钠的质量60g×10%=6g,因此可采取取20%的NaOH溶液的质量30g(6g÷20%=30g),加入30g(60g-30g=30g)水方案配制;也可采取取40g 5%的NaOH溶液加入4g(6g-40g×5%=4g)氧化钠固体和16g(60g-40g-4g=16g)水进行配制.故答案为:30g20%的NaOH溶液和30g水;40g 5%的NaOH溶液、4gNaOH固体和16g水
(2)①氢氧化钠有腐蚀性,称量时要放在玻璃器皿上.图上的氢氧化钠直接放在托盘上称量是错误的,故答案为:氢氧化钠直接放在纸上称量
②A、若砝码和氢氧化钠放错盘称量,如果没有用游码,质量分数不变,如果用了游码,称得的溶质的质量变小,其溶质的质量分数偏小;
B、b中烧杯用水洗涤后未干燥就使用,会导致水的质量增加,溶质的质量分数偏小;
C、c操作中平视量筒凹液面最低处读数为50mL,此操作是正确的,配制的溶液溶质质量分数不会偏低;
D、d操作中有少量水溅出,使得溶剂水的质量变小,溶质的质量分数偏大.
故选AB.
(2)①氢氧化钠有腐蚀性,称量时要放在玻璃器皿上.图上的氢氧化钠直接放在托盘上称量是错误的,故答案为:氢氧化钠直接放在纸上称量
②A、若砝码和氢氧化钠放错盘称量,如果没有用游码,质量分数不变,如果用了游码,称得的溶质的质量变小,其溶质的质量分数偏小;
B、b中烧杯用水洗涤后未干燥就使用,会导致水的质量增加,溶质的质量分数偏小;
C、c操作中平视量筒凹液面最低处读数为50mL,此操作是正确的,配制的溶液溶质质量分数不会偏低;
D、d操作中有少量水溅出,使得溶剂水的质量变小,溶质的质量分数偏大.
故选AB.
点评:本题主要考查配制溶液时的实验的设计、配制溶液时有关的误差分析和注意事项以及对化学用语的理解能力,其中配制溶液时的有关误差分析难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目



