题目内容
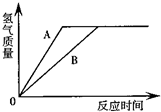 (2011?南昌)有等质量的A、B两金属,相对原子质量Ar(A)<Ar(B),将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的稀盐酸中,在反应中A、B均为正二价,产生氢气的质量随反应时间变化曲线如右图.下列说法正确的是( )
(2011?南昌)有等质量的A、B两金属,相对原子质量Ar(A)<Ar(B),将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的稀盐酸中,在反应中A、B均为正二价,产生氢气的质量随反应时间变化曲线如右图.下列说法正确的是( )分析:根据图象可以得出:①比较氢气的多少,从而可以判断出金属的相对原子质量的大小,得到氢气多的则相对原子质量小;②判断金属的活动性强弱,反应时间短或斜线斜率大的则该金属的活动性强.
解答:解:A、金属的活动性越强的,和酸溶液反应时产生气体的速率也就越快,根据图象不难看出,金属A完全反应后所需要的时间短,即A的活动性强,故A错误;
B、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,故B错误;
C、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,又因这两种酸溶液中溶质的质量分数相同,从而说明参与反应的两种酸的质量一定不一样多,故C正确;
D、由于A的相对原子质量小,因此得到相同质量的氢气,参加反应的金属A的质量要少一些,故D错误;
故选C
B、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,故B错误;
C、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,又因这两种酸溶液中溶质的质量分数相同,从而说明参与反应的两种酸的质量一定不一样多,故C正确;
D、由于A的相对原子质量小,因此得到相同质量的氢气,参加反应的金属A的质量要少一些,故D错误;
故选C
点评:本题难度较大,主要考查了金属的化学性质、金属活动性顺序的应用及有关的计算,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
(2011?南昌)对下列事实的解释正确的是( )
| 事 实 | 解 释 | |
| A | 氧气用于切割金属 | 氧气有可燃性 |
| B | 洗洁精可用于除油污 | 洗洁精能溶解油污 |
| C | 打开汽水瓶盖有大量气泡冒出 | 温度升高,气体溶解度减小 |
| D | 做铁丝燃烧实验时集气瓶底部预先要装少量的水 | 防止瓶底炸裂 |
(2011?南昌)对下列事实的解释正确的是( )
| 事 实 | 解 释 | |
| A | 氧气用于切割金属 | 氧气有可燃性 |
| B | 洗洁精可用于除油污 | 洗洁精能溶解油污 |
| C | 打开汽水瓶盖有大量气泡冒出 | 温度升高,气体溶解度减小 |
| D | 做铁丝燃烧实验时集气瓶底部预先要装少量的水 | 防止瓶底炸裂 |