题目内容
生石灰(CaO)在生活中常用作干燥剂,某化学研究性学习小组的同学对一包久置的生石灰干燥剂的成分产生了兴趣,进行了以下探究活动:提出问题:这包干燥剂久置后是否变质?成分是什么?
猜想与假设:
| 猜想 | 一 | 二 | 三 | 四 | 五 |
| 成分 | CaO | CaO、Ca(OH)2 | Ca(OH)2 | Ca(OH)2、CaCO3 | CaCO3 |
(1)取部分干燥剂于试管中,加水后无放热现象,说明这包干燥剂中不含______.
(2)继续向试管中滴加足量稀盐酸,有气泡出现,说明这包干燥剂含有______.
(3)为了进一步确定这包干燥剂中是否还含有其他成分,小组同学设计了以下实验方案:另取部分干燥剂于烧杯中,加水并搅拌,静置后取上层清液于3支试管中,并进行以下实验:
| 实验方案 | 一 | 二 | 三 |
| 实验操作 | 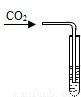 |  | 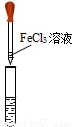 |
| 实验现象 | 澄清溶液变浑浊 | 溶液由无色变为红色 | 产生红褐色沉淀 |
| 化学方程式 | ______ | ______ |
拓展迁移:小组同学反思了生石灰干燥剂变质的原因,认识到实验室保存氧化钙应注意______.
【答案】分析:实验探究:
(1)根据生石灰与水反应生成熟石灰放出大量热,可知一定不含生石灰进行解答;
(2)根据加足量酸有气泡,推断肯定含有碳酸盐,由此可以判断出该干燥剂中一定含有碳酸钙;
(3)根据二氧化碳与石灰水反应生成碳酸钙沉淀和水,氢氧化钙与氯化铁反应生成氢氧化铁和氯化钙书写方程式;
实验结论:根据三个方案的实验探究,第一个方案通入二氧化碳变浑浊说明含有氢氧化钙,第二个实验方案指示剂的颜色变化肯定含有碱性物质,第三个方案也更说明含有氢氧化钙,由此得出猜想四是正确的;
拓展迁移:通过科学实验探究我们应该反思:在化学实验室保存氢氧化钙是一定不能敞口放置,否则会与空气中的二氧化碳发生反应而变质.
解答:解:实验探究:
(1)加水没有发热现象,根据氧化钙(生石灰)溶于水放热的特性可以判断一定没有生石灰存在;
(2)由于碳酸钙和盐酸反应放出二氧化碳气体,加入足量的酸有气泡产生说明该干燥剂中一定含有 CaCO3,但不能判断是否一定还有氢氧化钙,因Ca(OH)2 遇到酸不会有气泡产生,所以不能判定一定含有氢氧化钙;
(3)常用澄清的石灰水来检验二氧化碳的存在,它会变浑浊说明含有氢氧化钙,反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O;氢氧化钙溶液呈碱性,会使酚酞试液变红;同时氢氧化钙能和氯化铁反应生成红褐色的氢氧化铁沉淀和氯化钙,所以会看到有红褐色沉淀生成,方程式是:3Ca(OH)2+2FeCl3═3CaCl2+2Fe(OH)3↓;
实验结论:由以上实验探究得出猜想一,二,三都不可能有这几种情况的存在,所以猜想四成立;
拓展迁移:由于氢氧化钙会和空气中的二氧化碳发生反应而变质所以要避免与空气接触;
故答案为:实验探究:(1)CaO;
(2)CaCO3;
(3)Ca(OH)2+CO2═CaCO3↓+H2O; 3Ca(OH)2+2FeCl3═3CaCl2+2Fe(OH)3↓;
实验结论:四;
拓展迁移:密封保存.
点评:本题从生活中常见的食品干燥剂为情境角度出发,考查干燥剂是否变质,考查了学生对于CaO、Ca(OH )2、CaCO3 三者的性质的掌握和应用,尤其考查了学生在实验探究中推断分析能力.
(1)根据生石灰与水反应生成熟石灰放出大量热,可知一定不含生石灰进行解答;
(2)根据加足量酸有气泡,推断肯定含有碳酸盐,由此可以判断出该干燥剂中一定含有碳酸钙;
(3)根据二氧化碳与石灰水反应生成碳酸钙沉淀和水,氢氧化钙与氯化铁反应生成氢氧化铁和氯化钙书写方程式;
实验结论:根据三个方案的实验探究,第一个方案通入二氧化碳变浑浊说明含有氢氧化钙,第二个实验方案指示剂的颜色变化肯定含有碱性物质,第三个方案也更说明含有氢氧化钙,由此得出猜想四是正确的;
拓展迁移:通过科学实验探究我们应该反思:在化学实验室保存氢氧化钙是一定不能敞口放置,否则会与空气中的二氧化碳发生反应而变质.
解答:解:实验探究:
(1)加水没有发热现象,根据氧化钙(生石灰)溶于水放热的特性可以判断一定没有生石灰存在;
(2)由于碳酸钙和盐酸反应放出二氧化碳气体,加入足量的酸有气泡产生说明该干燥剂中一定含有 CaCO3,但不能判断是否一定还有氢氧化钙,因Ca(OH)2 遇到酸不会有气泡产生,所以不能判定一定含有氢氧化钙;
(3)常用澄清的石灰水来检验二氧化碳的存在,它会变浑浊说明含有氢氧化钙,反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O;氢氧化钙溶液呈碱性,会使酚酞试液变红;同时氢氧化钙能和氯化铁反应生成红褐色的氢氧化铁沉淀和氯化钙,所以会看到有红褐色沉淀生成,方程式是:3Ca(OH)2+2FeCl3═3CaCl2+2Fe(OH)3↓;
实验结论:由以上实验探究得出猜想一,二,三都不可能有这几种情况的存在,所以猜想四成立;
拓展迁移:由于氢氧化钙会和空气中的二氧化碳发生反应而变质所以要避免与空气接触;
故答案为:实验探究:(1)CaO;
(2)CaCO3;
(3)Ca(OH)2+CO2═CaCO3↓+H2O; 3Ca(OH)2+2FeCl3═3CaCl2+2Fe(OH)3↓;
实验结论:四;
拓展迁移:密封保存.
点评:本题从生活中常见的食品干燥剂为情境角度出发,考查干燥剂是否变质,考查了学生对于CaO、Ca(OH )2、CaCO3 三者的性质的掌握和应用,尤其考查了学生在实验探究中推断分析能力.

练习册系列答案
相关题目
 ,则锂离子的符号为
,则锂离子的符号为
 (2012?玄武区二模)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(2012?玄武区二模)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知: