题目内容
如图1为元素周期表的部分内容,结合表中内容回答问题.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | 1 H 氢 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2 He 氦 |
| 2 | 3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
| 3 | 11 Na 钠 | 12 Mg 镁 | 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氩 |

图2
(1)12号元素镁的元素符号为______.
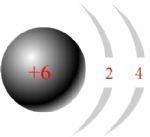
(2)氟元素的原子结构示意图为
 ,从原子结构分析,下列元素化学性质与氟相似的是______(填序号).
,从原子结构分析,下列元素化学性质与氟相似的是______(填序号).
(3)某种钠原子的相对原子质量为23,该钠原子核内的中子数为______.
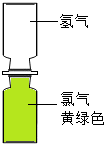
(4)小红取一瓶氢气和一瓶氯气进行实验.首先将氢气和氯气按图2所示装置放置,抽掉玻璃片,过一会观察到______,产生这一现象的原因是______.然后点燃一段镁条,靠近集气瓶,氢气和氯气在光照条件下发生爆炸,生成稳定的化合物氯化氢,该反应的化学方程式为______.
解:(1)12号元素镁的元素符号为镁元素,符号为Mg.
(2)氟元素的原子最外层有7个电子,最外层电子数相同的原子化学性质相似,故选③
(3)某种钠原子的相对原子质量为23,钠原子的质子数为11,相对原子质量等于质子数+中子数,所以钠原子核内的中子数为12.
(4)由于分子不断运动,所以当抽掉玻璃片时,氯气分子和氢气分子不断运动,上下都变为黄绿色,但颜色较原Cl2的颜色浅,氢气和氯气在光照条件下发生爆炸,生成稳定的化合物氯化氢,反应的化学方程式为:H2+Cl2 2HCl
2HCl
故答案为:(1)Mg.
(2)③
(3)12.
(4)上下都变为黄绿色,但颜色较原Cl2的颜色浅,分子在不断运动. H2+Cl2 2HCl
2HCl
分析:(1)根据质子数决定元素种类解答.
(2)最外层相似的原子化学性质相似.
(3)根据相对原子质量=质子数+中子数.
(4)根据分子不断运动解答.
点评:明确质子数决定元素种类,相对原子质量等于质子数+中子数,分子不断运动的知识是解答本题关健.
(2)氟元素的原子最外层有7个电子,最外层电子数相同的原子化学性质相似,故选③
(3)某种钠原子的相对原子质量为23,钠原子的质子数为11,相对原子质量等于质子数+中子数,所以钠原子核内的中子数为12.
(4)由于分子不断运动,所以当抽掉玻璃片时,氯气分子和氢气分子不断运动,上下都变为黄绿色,但颜色较原Cl2的颜色浅,氢气和氯气在光照条件下发生爆炸,生成稳定的化合物氯化氢,反应的化学方程式为:H2+Cl2
 2HCl
2HCl故答案为:(1)Mg.
(2)③
(3)12.
(4)上下都变为黄绿色,但颜色较原Cl2的颜色浅,分子在不断运动. H2+Cl2
 2HCl
2HCl分析:(1)根据质子数决定元素种类解答.
(2)最外层相似的原子化学性质相似.
(3)根据相对原子质量=质子数+中子数.
(4)根据分子不断运动解答.
点评:明确质子数决定元素种类,相对原子质量等于质子数+中子数,分子不断运动的知识是解答本题关健.

练习册系列答案
相关题目
如图1为元素周期表的部分内容,结合表中内容回答问题.
图1
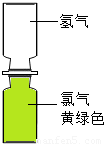
图2
(1)12号元素镁的元素符号为 .
(2)氟元素的原子结构示意图为 ,从原子结构分析,下列元素化学性质与氟相似的是 (填序号).
,从原子结构分析,下列元素化学性质与氟相似的是 (填序号).

(3)某种钠原子的相对原子质量为23,该钠原子核内的中子数为 .
(4)小红取一瓶氢气和一瓶氯气进行实验.首先将氢气和氯气按图2所示装置放置,抽掉玻璃片,过一会观察到 ,产生这一现象的原因是 .然后点燃一段镁条,靠近集气瓶,氢气和氯气在光照条件下发生爆炸,生成稳定的化合物氯化氢,该反应的化学方程式为 .
| 族 周期 | ⅠA | |||||||
| 1 | 1 H 氢 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2 He 氦 |
| 2 | 3 Li 锂 | 4 Be 铍 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
| 3 | 11 Na 钠 | 12 Mg 镁 | 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氩 |

图2
(1)12号元素镁的元素符号为 .
(2)氟元素的原子结构示意图为
 ,从原子结构分析,下列元素化学性质与氟相似的是 (填序号).
,从原子结构分析,下列元素化学性质与氟相似的是 (填序号).
(3)某种钠原子的相对原子质量为23,该钠原子核内的中子数为 .
(4)小红取一瓶氢气和一瓶氯气进行实验.首先将氢气和氯气按图2所示装置放置,抽掉玻璃片,过一会观察到 ,产生这一现象的原因是 .然后点燃一段镁条,靠近集气瓶,氢气和氯气在光照条件下发生爆炸,生成稳定的化合物氯化氢,该反应的化学方程式为 .
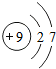 ,从原子结构分析,下列元素化学性质与氟相似的是
,从原子结构分析,下列元素化学性质与氟相似的是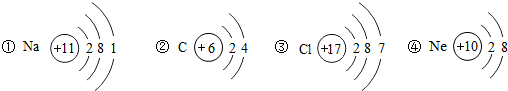
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容. D.碳的相对原子质量为12.01
D.碳的相对原子质量为12.01