题目内容
碳酸钙在高温条件下发生如下反应:CaCO3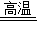 CaO+CO2↑,将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为40%,则生成的CO2的质量约为( )
CaO+CO2↑,将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为40%,则生成的CO2的质量约为( )A.20.0g
B.44.0g
C.56.0g
D.78.0g
【答案】分析:根据质量守恒定律可知,钙元素的质量在化学反应前后质量不变.根据已知的条件可以求出反应前钙元素的质量,然后再根据剩余固体中含钙元素的质量分数为41%,求出反应后剩余固体的总质量,根据反应前后的差值求出二氧化碳气体的质量.
解答:解:钙元素的质量=100g×80%× ×100%=32g;根据质量守恒定律可知,钙元素的质量在化学反应前后质量不变,则反应后剩余固体的总质量=
×100%=32g;根据质量守恒定律可知,钙元素的质量在化学反应前后质量不变,则反应后剩余固体的总质量=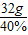 =80g
=80g
根据质量守恒定律可知:二氧化碳的质量=100g-80g=20g
故选A
点评:本题难度不是很大,主要考查了根据化学方程式进行相关的计算,从而培养学生的分析能力和计算能力.
解答:解:钙元素的质量=100g×80%×
 ×100%=32g;根据质量守恒定律可知,钙元素的质量在化学反应前后质量不变,则反应后剩余固体的总质量=
×100%=32g;根据质量守恒定律可知,钙元素的质量在化学反应前后质量不变,则反应后剩余固体的总质量=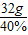 =80g
=80g根据质量守恒定律可知:二氧化碳的质量=100g-80g=20g
故选A
点评:本题难度不是很大,主要考查了根据化学方程式进行相关的计算,从而培养学生的分析能力和计算能力.

练习册系列答案
相关题目
 CaO+CO2↑.将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为( )
CaO+CO2↑.将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为( )