题目内容
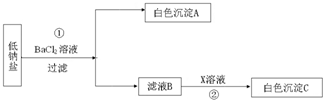
某种低钠盐由NaCl、KCl、MgSO4三种物质组成.用它进行以下实验(假设每步均恰好完全反应).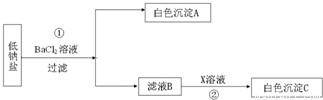
(1)写出步骤①的化学方程式: .
(2)当X是AgNO3时,白色沉淀C是 ,当X是NaOH时,白色沉淀C是 .
【答案】分析:根据已有的知识进行分析,低钠盐由NaCl、KCl、MgSO4三种物质组成,加入氯化钡,则硫酸镁与氯化钡反应生成硫酸钡沉淀和氯化镁,故A为硫酸钡,滤液B中含有氯化钠、氯化钾和氯化镁,根据加入的X判断生成的白色沉淀的种类.
解答:解:(1)加入氯化钡,则氯化钡与硫酸镁反应生成硫酸钡沉淀和氯化镁,故填:MgSO4+BaCl2═BaSO4↓+MgCl2;
(2)若X是硝酸银,则硝酸银能与滤液B中含有的氯离子结合生成氯化银沉淀,若X是氢氧化钠,则能与氯化镁反应生成氢氧化镁沉淀,故填:AgCl或氯化银,Mg(OH)2或氢氧化镁.
点评:本题考查了常见盐的性质,完成此题,可以依据已有的知识进行.
解答:解:(1)加入氯化钡,则氯化钡与硫酸镁反应生成硫酸钡沉淀和氯化镁,故填:MgSO4+BaCl2═BaSO4↓+MgCl2;
(2)若X是硝酸银,则硝酸银能与滤液B中含有的氯离子结合生成氯化银沉淀,若X是氢氧化钠,则能与氯化镁反应生成氢氧化镁沉淀,故填:AgCl或氯化银,Mg(OH)2或氢氧化镁.
点评:本题考查了常见盐的性质,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目