题目内容
(2008?杨浦区二模)某种低钠盐由NaCl、KCl、MgSO4三种物质组成.用它进行以下实验(假设每步均恰好完全反应).
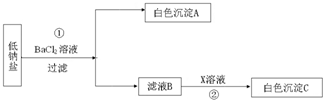
(1)写出步骤①的化学方程式:
(2)当X是AgNO3时,白色沉淀C是

(1)写出步骤①的化学方程式:
MgSO4+BaCl2═BaSO4↓+MgCl2
MgSO4+BaCl2═BaSO4↓+MgCl2
.(2)当X是AgNO3时,白色沉淀C是
AgCl或氯化银
AgCl或氯化银
,当X是NaOH时,白色沉淀C是Mg(OH)2或氢氧化镁
Mg(OH)2或氢氧化镁
.分析:根据已有的知识进行分析,低钠盐由NaCl、KCl、MgSO4三种物质组成,加入氯化钡,则硫酸镁与氯化钡反应生成硫酸钡沉淀和氯化镁,故A为硫酸钡,滤液B中含有氯化钠、氯化钾和氯化镁,根据加入的X判断生成的白色沉淀的种类.
解答:解:(1)加入氯化钡,则氯化钡与硫酸镁反应生成硫酸钡沉淀和氯化镁,故填:MgSO4+BaCl2═BaSO4↓+MgCl2;
(2)若X是硝酸银,则硝酸银能与滤液B中含有的氯离子结合生成氯化银沉淀,若X是氢氧化钠,则能与氯化镁反应生成氢氧化镁沉淀,故填:AgCl或氯化银,Mg(OH)2或氢氧化镁.
(2)若X是硝酸银,则硝酸银能与滤液B中含有的氯离子结合生成氯化银沉淀,若X是氢氧化钠,则能与氯化镁反应生成氢氧化镁沉淀,故填:AgCl或氯化银,Mg(OH)2或氢氧化镁.
点评:本题考查了常见盐的性质,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
 (2008?杨浦区二模)人体缺乏维生素C(简写“Vc”)就会患坏血病.右图所示为某种“维些素C”说明书的一部分.请你回答:
(2008?杨浦区二模)人体缺乏维生素C(简写“Vc”)就会患坏血病.右图所示为某种“维些素C”说明书的一部分.请你回答: (2008?杨浦区二模)小王自学化学,知道镁居然能在二氧化碳气体中燃烧,于是他迫不及待地做起了这个实验:将镁条点燃后迅速伸入盛二氧化碳的集气瓶中,发现镁条剧烈燃烧,发出白光,放热,产生一种白色粉末和一种黑色粉末.
(2008?杨浦区二模)小王自学化学,知道镁居然能在二氧化碳气体中燃烧,于是他迫不及待地做起了这个实验:将镁条点燃后迅速伸入盛二氧化碳的集气瓶中,发现镁条剧烈燃烧,发出白光,放热,产生一种白色粉末和一种黑色粉末.