题目内容
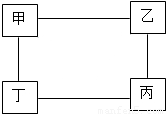
如右图所示,甲、乙、丙、丁分别为下列物质中的某一种:盐酸、硫酸、氢氧化钠和碳酸钠,图中直线相连的两种物质或其溶液都能相互发生反应.(1)浓盐酸曝露在空气中,其溶质的质量分数将 (填“变大”或“变小”).
(2)氢氧化钠固体可作干燥剂,它不能干燥的气体是 .
A、O2 B、CO2 C、H2 D、CO
(3)碳酸钠浓溶液与澄清石灰水反应的化学方程式为 .
(4)若甲为硫酸,则丙一定是 .从物质的分类看,若乙、丁可以用其它类别的物质替换,则可以替换乙的一种物质是 .
【答案】分析:(1)根据浓盐酸的性质结合溶液的组成来判断;
(2)氢氧化钠是碱性的物质,在吸收水分后能够和酸性的气体发生反应,可以据此解答;
(3)碳酸钠和澄清石灰水反应生成碳酸钙沉淀和氢氧化钠,可以据此写出该反应的化学方程式;
(4)根据酸的性质来判断物质可能的物质.
解答:解:(1)浓盐酸具有挥发性,若敞口放置则会由于溶质的减少而导致溶质的质量分数变小;
(2)氢氧化钠是碱,可以和酸性气体反应,所以不能干燥酸性气体,即所给的四种气体中不能被干燥的气体为二氧化碳,故选B;
(3)碳酸钠和澄清石灰水反应生成碳酸钙沉淀和氢氧化钠,故可以写出该反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)若甲为硫酸,则乙和丁分别为碳酸钠和氢氧化钠,因为它们都可以和硫酸反应,那么丙只能为盐酸;根据酸的性质可以知道,金属或是金属氧化物也可以和酸反应,所以乙和丁可以分别为活泼金属和金属氧化物.
故答案为:(1)变小;
(2)B;
(3)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)盐酸;Zn(或Fe2O3等).
点评:熟练掌握常见的酸和碱的化学性质,并知道氢氧化钠和浓硫酸都可以作为干燥剂,但是所干燥的物质不同,氢氧化钠常干燥中性和碱性气体,而浓硫酸常干燥中性和酸性气体.
(2)氢氧化钠是碱性的物质,在吸收水分后能够和酸性的气体发生反应,可以据此解答;
(3)碳酸钠和澄清石灰水反应生成碳酸钙沉淀和氢氧化钠,可以据此写出该反应的化学方程式;
(4)根据酸的性质来判断物质可能的物质.
解答:解:(1)浓盐酸具有挥发性,若敞口放置则会由于溶质的减少而导致溶质的质量分数变小;
(2)氢氧化钠是碱,可以和酸性气体反应,所以不能干燥酸性气体,即所给的四种气体中不能被干燥的气体为二氧化碳,故选B;
(3)碳酸钠和澄清石灰水反应生成碳酸钙沉淀和氢氧化钠,故可以写出该反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)若甲为硫酸,则乙和丁分别为碳酸钠和氢氧化钠,因为它们都可以和硫酸反应,那么丙只能为盐酸;根据酸的性质可以知道,金属或是金属氧化物也可以和酸反应,所以乙和丁可以分别为活泼金属和金属氧化物.
故答案为:(1)变小;
(2)B;
(3)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(4)盐酸;Zn(或Fe2O3等).
点评:熟练掌握常见的酸和碱的化学性质,并知道氢氧化钠和浓硫酸都可以作为干燥剂,但是所干燥的物质不同,氢氧化钠常干燥中性和碱性气体,而浓硫酸常干燥中性和酸性气体.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
 如右图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球体积的影响).则滴管和烧瓶中所用试剂可能是( ) 如右图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球体积的影响).则滴管和烧瓶中所用试剂可能是( )
|
 18、如右图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂不可能是( )
18、如右图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂不可能是( )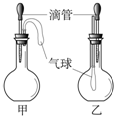 (2011?丹阳市二模)如右图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂可能是:( )
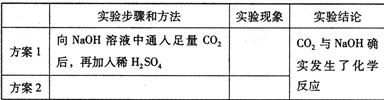
(2011?丹阳市二模)如右图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂可能是:( )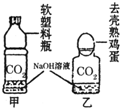 (2008?衡阳)实验室检验CO2通常用澄清石灰水,而吸收CO2通常用NaOH溶液,但CO2与NaOH溶液反应时无明显现象.振衡中学研究性学习小组就如何证明CO2与NaOH溶液确实发生了化学反应进行探究.
(2008?衡阳)实验室检验CO2通常用澄清石灰水,而吸收CO2通常用NaOH溶液,但CO2与NaOH溶液反应时无明显现象.振衡中学研究性学习小组就如何证明CO2与NaOH溶液确实发生了化学反应进行探究.