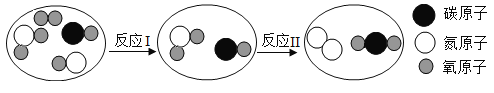
题目内容
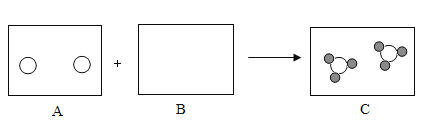
【题目】化学小组同学在一次实验中进行了如图所示的实验:
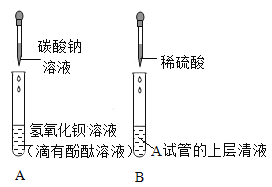
先向A中已有的溶液中滴入碳酸钠溶液,反应的化学方程式是_______;静置,将上层清液倒入B试管中,滴加一定量稀硫酸,开始时无明显现象,后出现气泡。则A溶液中的溶质为_________ 。(不考虑酚酞)
(提出问题)小组同学对加稀硫酸后所得溶液B产生了浓厚的兴趣,进行了进一步的探究活动。溶液B中含有那些离子。
(猜想与假设)小惠猜想:Na+ 、SO42-、H+
小胜猜想:Na+ 、SO42- CO32-
小利猜想:Na+ 、SO42- CO32-、OH-
(表达与交流)通过讨论大家认为小利猜想不成立,理由是_______;
(探究实验)小胜认为可以另取一定量的B溶液,加入足量的氯化钡溶液,观察到了_______的实验现象,即可验证溶质成分。
(归纳与总结)通过以上探究活动,小组同学总结出:分析反应后溶液中溶质成分时,不仅要考虑可溶性生成物一定存在,和____可能存在 ,还要结合实验现象,进行合理猜想;在确定反应后溶液中溶质的成分时,对所加试剂的要求有____(答一条即可)。
【答案】![]() 氢氧化钠和碳酸钠 产生气泡说明OH-已经反应完全 生成白色沉淀且溶液由红色变为无色 过量的可溶性反应物 明显的实验现象
氢氧化钠和碳酸钠 产生气泡说明OH-已经反应完全 生成白色沉淀且溶液由红色变为无色 过量的可溶性反应物 明显的实验现象
【解析】
先向A中已有的溶液中滴入碳酸钠溶液,氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,反应的化学方程式是![]() ;静置,将上层清液倒入B试管中,滴加一定量稀硫酸,开始时无明显现象,后出现气泡,说明碳酸钠过量。则A溶液中的溶质为氢氧化钠和碳酸钠。
;静置,将上层清液倒入B试管中,滴加一定量稀硫酸,开始时无明显现象,后出现气泡,说明碳酸钠过量。则A溶液中的溶质为氢氧化钠和碳酸钠。
[表达与交流]
将硫酸滴入碳酸钠和氢氧化钠的混合物中,硫酸先与氢氧化钠反应生成硫酸钠和水,再与氢氧化钠反应生成硫酸钠、水和二氧化碳。B试管中,滴加一定量稀硫酸,开始时无明显现象,后出现气泡,说明氢氧化钠已经反应完,碳酸钠与硫酸可能恰好完全反应,B中含有的离子为Na+ 、SO42-,若硫酸过量,含有的离子是Na+ 、SO42- 、H+,若碳酸钠过量,含有的离子是Na+ 、SO42- CO32- 。通过讨论大家认为小利猜想不成立,理由是产生气泡说明OH-已经反应完全;
[探究实验]
根据以上分析知,溶液B的成分可能有三种情况:①硫酸钠,②硫酸钠和碳酸钠,③硫酸钠和硫酸。硫酸钠呈中性,不能使酚酞变色,加入氯化钡,生成白色沉淀;碳酸钠呈碱性,使酚酞变红,生成白色沉淀;硫酸钠和硫酸的混合液呈酸性,不能使酚酞变色,加入氯化钡,生成白色沉淀;故若生成白色沉淀且溶液由红色变为无色,可以验证溶质成分。
[归纳与总结]
通过以上探究活动,小组同学总结出:分析反应后溶液中溶质成分时,不仅要考虑可溶性生成物一定存在,和过量的可溶性反应物可能存在 ,还要结合实验现象,进行合理猜想;在确定反应后溶液中溶质的成分时,对所加试剂的要求有明显的实验现象。