题目内容
【题目】钙是人体必须的常量元素,每日必须摄入足够量的钙.目前市场上的补钙药剂很多,如图是某种品牌的补钙药品的部分说明书.
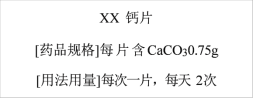
请完成下列计算,要求写出计算过程:相对原子质量C-12 O-16 Ca-40
(1)CaCO3的相对分子质量。________.
(2)CaCO3中钙元素的质量分数。________.
(3)如果按用量服用,求每天摄入钙元素的质量________。
(4)牛奶是含钙丰富又易吸收的理想食品,根据如图某乳业公司纯牛奶包装标签:

若人体每天至少需要0.6克钙,且这些钙主要来自牛奶,则一个人每天至少要喝这样的牛奶________盒.
【答案】100 40% 0.6g 2 盒
【解析】
解:(1)CaCO3的相对分子质量为40+12+16×3=100;
(2)CaCO3中钙元素的质量分数为=![]() ×100%=40%;
×100%=40%;
(3)每次服用一片,每天2次,每片含碳酸钙0.75g,每天摄入钙元素的质量为0.75g×2×40%=0.6g;
(4)每100mL中含钙至少为0.12g,每盒250mL,则每盒至少含钙元素的质量为0.12g×![]() =0.3g;0.6g÷0.3g/盒=2盒。
=0.3g;0.6g÷0.3g/盒=2盒。

 优加精卷系列答案
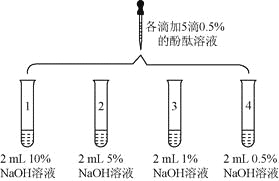
优加精卷系列答案【题目】(6分)众所周知,酚酞溶液遇![]() 溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
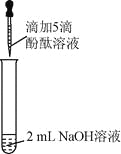
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与![]() 溶液和空气中的
溶液和空气中的![]() 反应有关。
反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
实验 | 实验操作 | 实验现象 | |
1 | 向盛有2 mL | 溶液变红 | |
2 |
| 1号试管 | |
3 | 取3支试管,分别加入2 mL水,…… | 酚酞溶液浓度/% | 浑浊程度] |
5 | 大量浑浊物 | ||
2 | 少量浑浊物 | ||
| 无浑浊物 | ||
【解释与结论】
(1)![]() 与
与![]() 反应的化学方程式为 。
反应的化学方程式为 。
(2)实验1的现象表明,猜想与假设1/span> (填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。
(4)实验3的操作步骤:取3支试管,分别加入![]() 水, 。
水, 。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为![]() ,建议选用NaOH溶液的浓度为 %。
,建议选用NaOH溶液的浓度为 %。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。
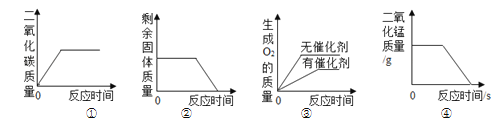
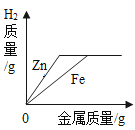
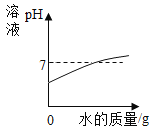
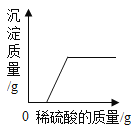
【题目】下列图像能正确反映其反应过程的是
|
|
|
|
A高温煅烧一定质量的石灰石 | B向等质量、等浓度的稀硫酸中分别加入过量的Zn和Fe | C向一定量稀硫酸中逐渐加入水 | D向一定量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸 |
A.AB.BC.CD.D