题目内容
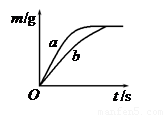
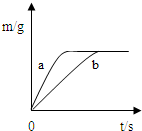
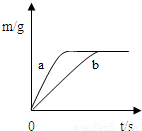
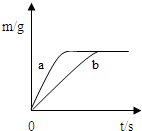
将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、浓度相同的稀硫酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲线如下图所示。下列说法正确的是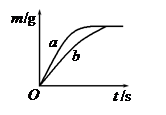
| A.曲线a表示铁和稀硫酸的反应 |
| B.两烧杯中金属都没有剩余 |
| C.两烧杯中硫酸都没有剩余 |
| D.消耗两种金属的质量相等 |
C
解析试题分析:由题中图像可知,a反应较b快,故曲线a表示锌和稀硫酸的反应;
最终产生的氢气的质量相等,这说明两烧杯中金属都是足量甚至过量的,硫酸没有剩余;
消耗两种金属的质量不相等,消耗锌的质量大于铁的质量。
选C。
考点:金属活动性顺序;化学反应中的数量关系。
点评:金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。
在金属活动性顺序中,氢前的金属能与酸发生置换反应,且位置越靠前,反应越剧烈。
同是正二价金属与酸反应,相对原子质量越大的金属,反应产生的氢气越少。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、浓度相同的稀硫酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲线如下图所示.下列说法正确的是( )
将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、浓度相同的稀硫酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲线如下图所示.下列说法正确的是( )