题目内容
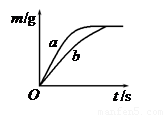
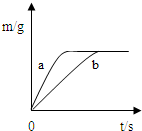
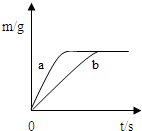
将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、浓度相同的稀硫酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲线如下图所示.下列说法正确的是( )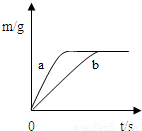
A.曲线a表示铁和稀硫酸的反应
B.两烧杯中金属都没有剩余
C.两烧杯中硫酸都没有剩余
D.消耗两种金属的质量相等
【答案】分析:由已知:“用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应”:
A、锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,据此分析解答;
B、由图象可知生成的氢气相等,故同质量金属与酸反应生成氢气较多的金属一定有剩余,据此解答;
C、根据生成的氢气质量相等,所以可知盐酸均反应完;
D、根据计算的分析如果锌、铁反应的质量相等,则产生的氢气一定不等.
解答:解:根据氢气的质量= ×金属的质量进行分析如下:
×金属的质量进行分析如下:
A、因为锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,曲线a表示锌和稀硫酸的反应,故A说法错误;
B、由图象可知生成的氢气相等,故同质量金属与酸反应生成氢气较多的金属一定有剩余,由于氢气的质量=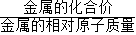 ×金属的质量,所以可知铁一定有剩余,故B说法错误;
×金属的质量,所以可知铁一定有剩余,故B说法错误;
C、由图象可知生成的氢气相等,由B的分析可知铁一定有剩余,故两硫酸均反应完全反应,只有这样生成的氢气才可能相等;故C说法正确;
D、由以上的分析可知同质量的锌和铁与足量的稀硫酸反应时,铁生成的氢气多,故消耗两种金属的质量相等则产生的氢气一定不等,故D说法错误.
故选C
点评:本题主要考查了金属的化学性质及其应用,掌握金属活动性顺序及其应用和酸的化学性质;学会利用化学方程式的计算来解决问题
A、锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,据此分析解答;
B、由图象可知生成的氢气相等,故同质量金属与酸反应生成氢气较多的金属一定有剩余,据此解答;
C、根据生成的氢气质量相等,所以可知盐酸均反应完;
D、根据计算的分析如果锌、铁反应的质量相等,则产生的氢气一定不等.
解答:解:根据氢气的质量=
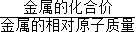 ×金属的质量进行分析如下:
×金属的质量进行分析如下:A、因为锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,曲线a表示锌和稀硫酸的反应,故A说法错误;
B、由图象可知生成的氢气相等,故同质量金属与酸反应生成氢气较多的金属一定有剩余,由于氢气的质量=
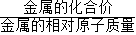 ×金属的质量,所以可知铁一定有剩余,故B说法错误;
×金属的质量,所以可知铁一定有剩余,故B说法错误;C、由图象可知生成的氢气相等,由B的分析可知铁一定有剩余,故两硫酸均反应完全反应,只有这样生成的氢气才可能相等;故C说法正确;
D、由以上的分析可知同质量的锌和铁与足量的稀硫酸反应时,铁生成的氢气多,故消耗两种金属的质量相等则产生的氢气一定不等,故D说法错误.
故选C
点评:本题主要考查了金属的化学性质及其应用,掌握金属活动性顺序及其应用和酸的化学性质;学会利用化学方程式的计算来解决问题

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、浓度相同的稀硫酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲线如下图所示。下列说法正确的是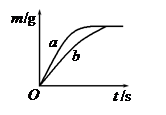
| A.曲线a表示铁和稀硫酸的反应 |
| B.两烧杯中金属都没有剩余 |
| C.两烧杯中硫酸都没有剩余 |
| D.消耗两种金属的质量相等 |
 将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、浓度相同的稀硫酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲线如下图所示.下列说法正确的是( )
将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、浓度相同的稀硫酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲线如下图所示.下列说法正确的是( )