题目内容
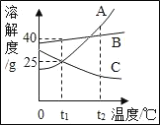
【题目】CaSO42H2O受热会逐步失去结晶水.取纯净的CaSO42H2O固体3.44g进行加热,测定固体质量随温度的变化情况如图所示.C点固体的化学式是_____.T3~T4温度段加热固体所产生的气体是形成酸雨的主要物质之一,则D~E段发生反应的化学方程式为_____.

【答案】2CaSO4H2O 2CaSO4![]() 2CaO+2SO2↑+O2↑
2CaO+2SO2↑+O2↑
【解析】
设:C点固体的化学式是CaSO4xH2O。
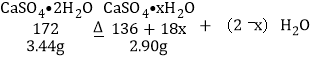
![]() x=0.5。C点固体的化学式是2CaSO4H2O;
x=0.5。C点固体的化学式是2CaSO4H2O;
设:G点固体的化学式是CaSO4yH2O。
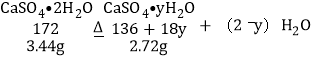
![]() y=0 ;G点固体的化学式是CaSO4;T3~T4温度段加热固体的反应物是CaSO4;T3~T4温度段加热固体所产生的气体是形成酸雨的主要物质之一,说明D~E段生成了二氧化硫;根据质量守恒定律可知,硫酸钙在高温的条件下生成氧化钙、二氧化硫和氧气,化学方程式为:
y=0 ;G点固体的化学式是CaSO4;T3~T4温度段加热固体的反应物是CaSO4;T3~T4温度段加热固体所产生的气体是形成酸雨的主要物质之一,说明D~E段生成了二氧化硫;根据质量守恒定律可知,硫酸钙在高温的条件下生成氧化钙、二氧化硫和氧气,化学方程式为:![]() 。
。

【题目】现有一种不纯的氧化铁粉末样品(杂质为铁粉),小刚和小强通过实验测定样品中氧化铁的质量分数.请你回答相关问题:
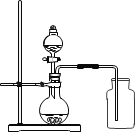
(1)小刚称取10g样品,利用如图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
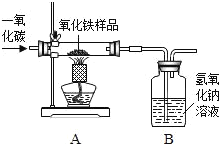
编号 | 称量物 | 反应前 | 反应后 |
一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
二 | B装置总质量 | 153.7g | 160.3g |
①由上表的数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是_____的质量.
②请根据B装置总质量变化的数据,计算出样品中氧化铁的质量分数_____(写出计算过程).
(2)为达到同样的实验目的,小强设计的方案为:将一定质量的样品于过量的稀盐酸反应,准确称量反应前、后固体和液体物质的总质量,据此可求出氧化铁的质量分数.
请你分别对小刚和小强设计的实验方案进行评价(各写出一条即可):_____.
(3)如果小强还想计算出所用稀盐酸的溶质质量分数,请简要说明对其方案的改进方法及原因:_____;_____.