题目内容
【题目】碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域。为测定碳酸镁晶须中n的值,学习小组设计了如下装置并进行了3次实验:(不考虑稀盐酸挥发)
【查阅资料】:
a、碳酸镁晶须受热分解,生成3种氧化物;
b、相对分子质量:[Mr(MgCO3)∶84、Mr(H2O)∶18、Mr(MgO)∶40、Mr(CO2)∶44]
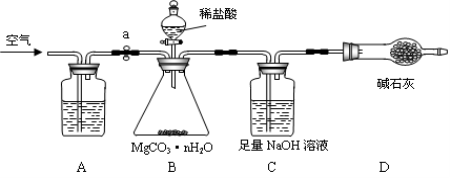
【实验步骤】
①
②准确称取3.45g MgCO3·nH2O放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,称量C装置的质量;
④关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止;
⑤打开弹簧夹a, ;
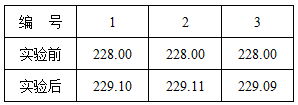
⑥准确称量C装置的质量(如右表);
⑦重复上述步骤;
⑧根据数据进行计算。
【实验分析及数据处理】
(1)A装置中盛放的溶液是 ,其目的是
(2)D装置的作用是 ;
(3)计算碳酸镁晶须中的n值: (要有计算过程)
【实验反思】
(4)实验结果与理论值有偏差,可以在B、C增加一个 装置以减少误差;
(5)下列选项中,会造成实验结果偏大的是 ;偏小的是 ;
①反应结束后,没有通空气;
②称量C装置前,没有通空气;
③没有A装置;
④没有D装置;
(6)为精确测定n的值,在老师指导下,小组同学称取13.8 g MgCO3·nH2O进行热重分析,并绘制出如图所示的热重曲线示意图。则:
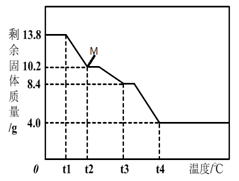
①t2℃时,剩余固体为 (填化学式);
②最终剩余的4.0 g物质是 (填化学式);
③碳酸镁晶须完全分解的化学方程式为: 。
【答案】实验步骤:检查装置气密性 鼓入空气一段时间
(1)氢氧化钠溶液 除去空气中二氧化碳
(2)防止空气中二氧化碳进入C装置
(3)n=3(4)浓硫酸吸水(5)②③④ ①
(6)MgCO3·H2O;MgO MgCO3·3H2O![]() MgO + CO2↑ + 3H2O
MgO + CO2↑ + 3H2O
【解析】
试题分析:通过实验装置和实验分析可知:第一步骤首先是检查装置的气密性,这是保证实验成功的关键;第⑤步中,打开弹簧夹a,缓缓鼓入空气,是为了把整个装置中的二氧化碳排出去;A装置中盛放的溶液是NaOH(浓)溶液,是用来吸收鼓入空气中的二氧化碳,可以减少误差;D装置的作用是:防止空气中的CO2进入C装置,造成误差. D装置的作用是:防止空气中的CO2进入C装置,造成误差,防止空气中的CO2进入C装置,造成误差,实验C装置平均增重(1.1+1.11+1.09)g/3=1.1g
MgCO3?nH2O~CO2
84+18n 44
3.45g 3g
列比例式得(84+18n):3.45克=44:1.1克 解得n=3,
实验结果与理论值有偏差,可以在B、C增加一个除去氯化氢气体的装置,防止质量增大;②称量C装置前,没有通空气;③没有A装置; ④没有D装置;都会使得数值偏大,反应结束后,没有通空气,使得气体不能完全进入C装置,使得数据偏小;从图示看:最终剩余的4.0 g物质时,表明反应恰好结束,所以剩余物质为:MgO;反应为:MgCO3·3H2O ![]() MgO + CO2↑ + 3H2O;
MgO + CO2↑ + 3H2O;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案