题目内容
【题目】海洋是人类的巨大资源宝库,试回答下列相关问题:
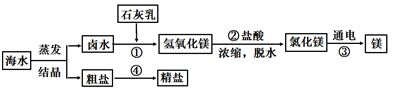
(1)请写步骤①的化学方程式:____________________。
(2)在步骤④进行粗盐提纯时,溶解、过滤、蒸发(结晶)三步操作中都要用到的玻璃仪器为______。
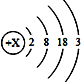
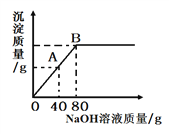
(3)广泛应用于火箭、导弹和飞机制造业的金属镁,就是利用从海水中提取的镁盐制取的。工业上从海水中提取单质镁的,某同学在实验室中用NaOH溶液代替石灰乳模拟步骤①的生产过程,取NaCl和MgCl2,的固体混合物12g,加入适量水完全溶解后,与溶质质量分数为10%的NaOH溶液混合充分反应,记录生成的沉淀与加入NaOH溶液质量关系如图所示:
①滴入上述NaOH溶液至图中A点时,烧杯中溶液里含有的溶质为_____________(写化学式)。
②滴入上述NaOH溶液80g时,试通过计算,求此时烧杯中Mg(OH)2沉淀质量(计算结果精确至0.1g)__。
【答案】 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 玻璃棒 MgCl2 、NaCl 5.8g。
【解析】(1)海水中的氯化镁能和氢氧化钙反应生成氢氧化镁沉淀,化学方程式为:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;(2)在步骤④进行粗盐提纯时,溶解、过滤、蒸发(结晶)三步操作中都要用到的玻璃仪器为玻璃棒;(3)①滴入上述NaOH溶液至图中A点时,氯化镁过量,氢氧化钠和氯化镁反应生成氯化钠和氢氧化镁白色沉淀,故烧杯中溶液里含有的溶质为:MgCl2 、NaCl;(3)①根据曲线可知,当滴入80gNaOH溶液时,MgCl2完全反应,生成氯化钠和氢氧化镁沉淀,设与80g10%的NaOH溶液完全反应生成氢氧化镁的质量为![]() ,
,
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
80 58
80g×10% ![]()
![]() ,
,![]() =5.8g。
=5.8g。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案