题目内容
【题目】(1+1+3=5分)某环保小组监测到一工厂排放的废水中含有H2SO4和CuSO4 。为了测定废水中CuSO4的质量分数,该小组取了100g废水,逐滴加入10%的NaOH溶液至过量。测得生成Cu(OH)2沉淀质量与所加NaOH溶液质量关系如下图所示。
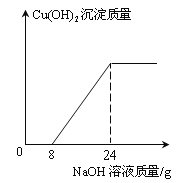
(1)与H2SO4反应的NaOH溶液质量为 g;100g废水中H2SO4的质量为 g。
(2)计算废水中CuSO4的质量分数。
【答案】(1) 8 0.98
(2) ![]()
相对分子质量 ![]()
![]()
![]()
![]()
![]()
解得![]()
所以![]()
所以![]() 的质量分数为3.2%。
的质量分数为3.2%。
【解析】
试题分析∶(1)由图表知 与H2SO4反应的NaOH溶液质量为8 g,由关系式H2SO4 →→→→ 2NaOH 得 100g废水中H2SO4的质量为0.98g
(2)由关系式 ![]()
相对分子质量 ![]()
![]()
![]()
![]()
![]()
解得![]()
所以![]()
所以![]() 的质量分数为3.2%。
的质量分数为3.2%。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目



