题目内容
两份完全相同的稀盐酸分别与等质量的锌粉和镁粉反应,下列情况无法用所给图像表示的是
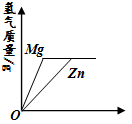

| A.x轴表示加入金属质量 |
| B.x轴表示加入稀盐酸的质量 |
| C.x轴表示反应时间,Zn与稀盐酸恰好完全反应 |
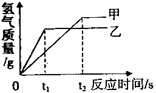
| D.x轴表示反应时间,Mg和Zn都有剩余 |
B
试题分析:根据金属与酸的反应,结合图像分析。
A.若x轴表示加入金属的质量,则该反应为足量的锌粉和镁粉,分别与两份完全相同的稀盐酸反应,结合反应的化学方程式Mg+2HCl= MgCl2+H2↑,Zn+2HCl=ZnCl2+H2↑可知,Mg与HCl的质量比=24:73,Zn与HCl的质量比=65:73,即消耗等质量的盐酸,所需镁的质量较小;且由于两份完全相同的稀盐酸均会完全反应,所以生成的氢气的质量相等,符合图示,正确;
B.若x轴表示加入稀盐酸的质量,则该反应为等质量的锌粉和镁粉,分别与足量的稀盐酸反应,结合反应的化学方程式Mg+2HCl= MgCl2+H2↑,Zn+2HCl=ZnCl2+H2↑可知,Mg与H2的质量比=24:2,Zn与H2的质量比=65:2,即等质量的锌粉和镁粉完全反应,产生的氢气是不一样多的,与图像不符,错误;
C. D.若x轴表示反应时间,根据金属的活动性顺序可知,金属镁的活动性大于锌,故镁与稀盐酸反应比锌与稀盐酸反应快,即在相同时间内,镁反应所放出氢气的质量大于锌,也就是表示镁的斜线要更靠近纵轴;结合图像,由于最终生成的氢气的质量相同,则说明与金属反应的酸的质量是相同的,结合上面的分析可知,消耗等质量的盐酸,所需镁的质量较小,故镁一定有剩余,而Zn可能与稀盐酸恰好完全反应,有可能有剩余,均正确。故选B
点评:等质量的金属与足量的酸完全反应时,可根据金属活动性顺序,判断金属与酸反应的快慢;根据金属与氢气的质量比,判断放出氢气质量的大小;而等质量的酸与足量的金属完全反应时,生成的氢气的质量一定相等,也可根据金属与酸的质量比,判断消耗的金属的质量,解答此类问题,多由这两个方面进行判断。

练习册系列答案
相关题目