题目内容
【题目】纯净的氯化钠用途广泛。由于粗盐中含有少量的MgCl2、CaCl2、Na2SO4等杂质,限制了它的用途。现对其进行以下操作来提纯:
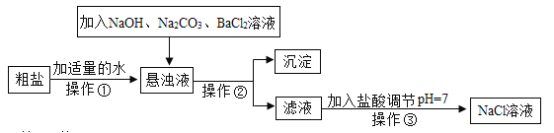
(1)向悬浊液中加入BaCl2和Na2CO3溶液的顺序不能颠倒,请解释其原因。______
(2)写出一个过程③中发生的化学反应的化学方程式。______
(3)实验所得精盐的质量______(选填“大于”、“小于”或“等于”)粗盐中氯化钠的质量。
【答案】若顺序颠倒,过量的BaCl2无法除去。 NaOH+HCl===NaCl+H2O(或Na2CO3+2HCl===2NaCl+H2O+CO2↑) 大于
【解析】
(1)氢氧化钠与氯化镁反应生成氢氧化镁和氯化钠,氯化钡和硫酸钠反应会生成硫酸钡沉淀和氯化钠,碳酸钠与氯化钙反应生成碳酸钙和氯化钠,碳酸钠能与氯化钡反应生成碳酸钡和氯化钠,向悬浊液中先加入BaCl2再加入Na2CO3溶液,能除去过量的氯化钡;氯化钡溶液和碳酸钠溶液的顺序不能颠倒,若颠倒过量的BaCl2无法除去;
(2)根据流程图可知,滤液中存在氯化钠,过量的氢氧化钠、碳酸钠,加入盐酸后,氢氧化钠与盐酸反应生成氯化钠和水,碳酸钠和盐酸反应会生成氯化钠、水和二氧化碳,反应的化学方程式为:NaOH+HCl===NaCl+H2O(或Na2CO3+2HCl===2NaCl+H2O+CO2↑);
(3)除杂过程都会生成氯化钠,所以实验所得精盐质量大于粗盐中氯化钠质量。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
次 数 | 1 | 2 | 3 | 4 | 5 |
加入碳酸钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表中x的数值为_____。第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少_____?
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少_____?