题目内容
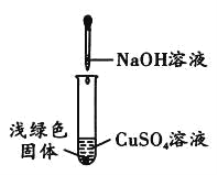
【题目】兴趣小组实验中,将NaOH溶液滴入CuSO4溶液中,结果溶液中生成了浅绿色的固体。于是,他们对该浅绿色固体的成分进行探究。
(查阅资料)
①NaOH与CuSO4反应会生成Cu(OH)2,也会生成Cu2(OH)2SO4(碱式硫酸铜)。
②Cu(OH)2在80℃会分解生成CuO
③Cu2(OH)2SO4不溶于水,能与酸反应,分解温度需300℃
(猜想与假设)
猜想一:浅绿色固体为Cu(OH)2;
猜想二:浅绿色固体为Cu2(OH)2SO4;
猜想三:浅绿色固体为Cu(OH)2和Cu2(OH)2SO4。
(获取事实与证据)
(1)取少量浅绿色固体放入试管中,加热至100℃,观察到黑色固体物质,说明浅绿色固体中存在_____。
(2)另取少量浅绿色固体放入试管中,加入足量稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀,该白色沉淀_____。(填化学式)
(3)(结论)分析整个实验现象,你能得出的实验结论是_____。
(4)(应用)碱式硫酸铜在植物表面上能逐步释放铜离子,抑制真菌孢子萌发和菌丝发育,能有效防治作物的真菌及细菌性病害。农业上常用作_____。
【答案】氢氧化铜 BaSO4 浅绿色固体为Cu(OH)2和Cu2(OH)2SO4 灭菌剂
【解析】
(1)根据氢氧化铜和碱式硫酸铜分解温度的不同进行解答;
(2)不溶于酸的白色沉淀应该是硫酸钡,据此分析所含物质;
(3)根据前面的现象,确定那个猜想正确;
(4)由题意可知,碱式硫酸铜能有效防治作物的真菌及细菌性病害,所以农业上常用作灭菌剂。
(1)黑色固体物质肯定是氧化铜,它可能是氢氧化铜分解而成,也可能是碱式硫酸铜分解而成。由于温度只有100℃远远低于300℃所以浅绿色固体中存在Cu(OH)2;
(2)加入稀硝酸后,Cu2(OH)2SO4与酸反应生成稀硫酸,滴加Ba(NO3)2溶液,仍然出现白色沉淀,那么白色沉淀肯定是硫酸钡;
(3)根据(1)(2)中现象可知,浅绿色固体中含有Cu(OH)2、Cu2(OH)2SO4,整个实验证明猜想三正确;
(4)由题意可知,碱式硫酸铜能有效防治作物的真菌及细菌性病害,所以农业上常用作灭菌剂。

【题目】空气中氧气含量测定的再认识:
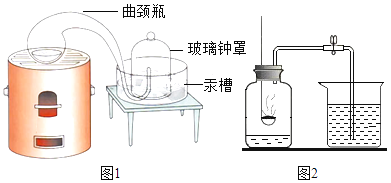
(1)[经典赏析]拉瓦锡用定量的方法研究空气的成分(实验装置如图1)。该实验中选择使用汞的优点有_____
A 汞俗称水银,常温下呈液态,安全无毒 B 能将密闭装置内空气中的氧气几乎耗尽
C 反应生成的氧化汞是固态,不影响压强 D 生成的化合物加热分解又能得到汞和氧气
(2)(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的符号表达式_______。图2中集气瓶底部的水的作用为_____。(填一点即可)但是用该方法测出的氧气含量常常低于21%。
(3)(提出问题)用该方法测出的氧气含量为什么低于21%?
(进行猜想)①装置漏气;②_____,装置内氧气有剩余;

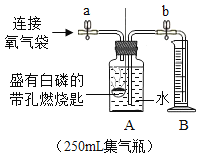
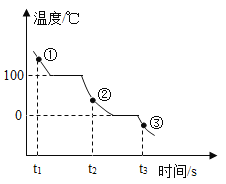
(4)(实验与交流)为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师利用传感器技术定时测定了实验装置(如图5)内的压强、温度和氧气浓度,三条曲线变化趋势如图6所示。X曲线表示压强变化趋势,Y曲线表示_____(填“温度”或“氧气浓度”)变化趋势。

(5)(实验探究1)已知,铁丝在纯氧中才能燃烧,反应的符号表达式为_____,一般不能在空气中燃烧,因此无法用铁丝代替红磷进行该实验。小明根据铁生锈的原理(铁在常温下可以和氧气、水生成铁锈)来测定空气中氧气的含量,于是进行了实验(装置如图3)。通过7天测得的数据计算出空气中氧气的含量为19.13%。
(交流与反思)与用红磷燃烧的方法相比,用铁丝生锈的方法的主要优点_____(填字母)。
A 装置内残留的氧气更少 B 铁丝生锈比红磷燃烧反应更快 C 反应更彻底,实验结果更准确
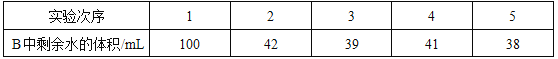
(6)(实验探究2)小明利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4)。8分钟后测得的数据如下表:请计算出空气中氧气含量______(计算结果保留一位小数)。
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.4mL |
(7)(拓展延伸)铜能与空气中氧气、水、二氧化碳反应生成铜绿(其主要成分为:Cu2(OH)2CO3).写出生成铜绿的符号表达式_____。
(8)请计算:Cu2(OH)2CO3的相对分子质量是_____。