题目内容
【题目】某化学小组利用下图所示的装置探究木炭粉和氧化铜反应后气体产物的成分。已知,该装置气密性良好;反应前木炭粉和氧化铜的质量为 12.80g,玻璃管质量为52.30g;反应后玻 璃管及其剩余固体的总质量为 64.81g,装置 B 增重 0.22g,装置 C 质 量未改变(N2不参加反应,不考虑外界空气对实验的影响)。
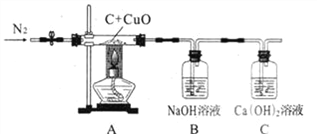
(1)玻璃管中的实验现象是______。
(2)由题干数据______可知,实验中木炭和氧化铜反应后的气体成分中含有CO2,再 由_________(列式推演即可)可知还产生了另外一种气体 CO。
(3)玻璃管中反应结束后仍要缓缓通入氮气将装置内残留的气体生成物排出,否则会使 B 装置的增重数据________(“偏大”、“偏小”或“无影响”)。
(4)实验评价:该套实验装置的缺陷和改进措施是_______。
【答案】 黑色固体变红 0.22(g) 12.80g+52.30g-64.81g=0.29g>0.22g 偏小 没有尾气处理装置,在尾处套气球/酒精灯点燃
【解析】(1)碳和氧化铜反应生成二氧化碳和铜,用酒精灯给碳和氧化铜的混合粉末加热后还原出的单质铜,会看到慢慢有红色物质出现;
(2)装置 B 中氢氧化钠溶液吸收二氧化碳,增重 0.22g即为吸收二氧化碳0.22g,根据质量守恒定律,反应前后的物质的总质量不变,反应生成气体的质量为12.80g+52.30g-64.81g=0.29g>0.22g,一氧化碳与氢氧化钠溶液不反应,装置B增重0.22g,装置C质量未改变,说明生成的二氧化碳被氢氧化钠溶液完全吸收,0.29g>0.22g,说明生成的气体中含有一氧化碳和二氧化碳;
(3)反应结束后仍缓慢通氮气至玻璃管冷却到室温,是为了将装置内残余的二氧化碳全部排入装置B中同时又可防止玻璃管内温度降低B中的液体倒吸入玻璃管内,所以反应结束后不缓慢通氮气,造成B 装置的增重数据偏小;
(4)由于实验中生成了一氧化碳,一氧化碳有毒,排放到空气中会造成大气污染,所以要进行尾气处理。

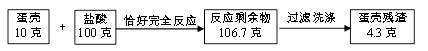
【题目】某校学校小组的同学为了测定某石灰石中碳酸钙的质量分数,他们取该石灰石样品 10g 加入烧杯中,再把 100g 稀盐酸分四次加入,实验过程所得数据如下表(已知石 灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
实验次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 7 | 4 | 2.6 | m |
分析表中数据,完成下列问题:
(1)表中 m 的数值为_____。
(2)求实验中所用盐酸的质量分数为__________。
(3)计算第 1 次试验反应结束后所得溶液中溶质质量分数为__________。