题目内容
【题目】水是生命之源,我们应该了解水、爱护水资源.
(1)保持水的化学性质的最小微粒是(用化学用语答)________ 水;
(2)自来水生产过程中,除去水中不溶性杂质可采用的方法是沉降或过滤 _______;
(3)常见的几种净水方法中,净化程度最高的操作是蒸馏 _______.
(4)“水”在化学实验中的作用不可小视,请回答:
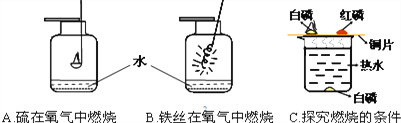
实验A中水的作用是吸收生成的二氧化硫 ______________________;实验B中水的作用是____________________;
实验C中的水除提供热量外,还起到了隔绝空气 ______________作用.
(5)下列关于生理盐水的说法中,不正确的是________D(填字母).
A.生理盐水的溶剂是水 B.各部分一样咸,体现了溶液具有均一性的特征
C.饮用生理盐水可以为人体补充无机盐 D.氯化钠分子是保持氯化钠化学性质的最小微粒
(6)在细菌作用下,可以用氨气处理含有甲醇(CH3OH)的工业废水,有关反应的化学方程式为
5CH3OH+12O2+6NH3 ===3X+5CO2+19H2O,则X的化学式为__________。
【答案】 H2O 过滤 蒸馏 吸收二氧化硫,以免污染空气 防止高温产物溅落,炸裂瓶底 隔绝氧气 D N2
【解析】(1). 构成物质的微粒就是保持物质化学性质的微粒,水由水分子构成,所以由水分子保持化学性质; (2). 过滤能将难溶性固体与液体分离; (3). 在水的净化过程中,自然沉降,是重力的作用下,水中的较大的、重的不溶物下沉;吸附沉降即化学沉降,是利用明矾在水中形成絮状物质,使悬浮颗粒聚集而沉降;过滤除掉沉降还不能除掉的小颗粒不溶物;蒸馏是加热到水的沸点使水从混合物中蒸发出来,然后再被冷凝成液态的水,得到的蒸馏水是纯净物。其中净化程度最高的方法是蒸馏。 (4).二氧化硫能溶于水,并与水反应生成亚硫酸,如果能与雨水作用形成酸雨,实验A中水的作用吸收二氧化硫,以免污染空气 ,(5). 铁在氧气中国燃烧火星四射,生成黑色固体,所以铁燃烧实验中,常在集气瓶底留少量的水或细沙,防止高温产物溅落,炸裂瓶底 ; (6). 实验C中的水除提供热量外,还起到了隔绝空气隔绝氧气,所以水中的白磷因接触不到氧气,而不能燃烧。 (7). 生理盐水是溶液,溶剂是水,溶质是氯化钠, 具有均一性那个、稳定性溶液各处的组成和性质完全相同,其溶质氯化钠是人体需要的营养素:无机盐;保持氯化钠化学性质的最小微粒 是其构成微粒:钠离子和氯离子;(8). 据质量守恒定律可知反应前后,原子的种类个数不变,所以X的化学式为N2

【题目】钙及其化合物在生产、生活中具有广泛的应用。
(一)钙的广泛用途
(1)高钙奶中含钙,这里的钙是指_____。(选填序号,下同)
a.单质 b.元素 c.原子
(2人体中钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙[Ca10(PO4)6(OH)2]形式存在,其中磷元素化合价为___________。
(3)混凝土中也含有一定量的含钙物质,钢筋与混凝土混合形成钢筋混凝土,以上叙述中不涉及的材料是____。
a.无机材料 b.合成材料 c.复合材料
(二)轻质CaCO3的制备
某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,流程如下:

(1)反应Ⅱ中先通NH3,再通CO2的目的是_______,化学方程式为______。
(2)反应Ⅲ中相关物质的溶解度如下表。你认为反应Ⅲ在常温下能实现的原因是______。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(3)判断CaCO3固体已洗涤干净的方法是____________________;
K2SO4晶体洗涤时,不可选用下列________洗涤剂(填字母编号)。
A.热水 B.冰水 C.饱和K2SO4溶液
(三)CaSO4xH2O成分测定
上述流程中分离所得的CaSO4xH2O中含有一定量的CaCO3。实验小组为了测定CaSO4xH2O中x的值及含量,取22.20g样品加热至900℃,将得到的气体先通过浓硫酸,再通入碱石灰,测得实验数据如下表:
名称 | 浓硫酸 | 碱石灰 |
实验前 | 100.00 | 100.00 |
实验后 | 103.60 | 102.20 |
【资料】已知CaSO4xH2O在160℃生成CaSO4, CaCO3在900℃时分解完全。
(1)CaSO4xH2O的质量为_____。
(2)x的值___________。
(四)CaSO4xH2O的性质探究
CaSO4xH2O受热会逐步失去结晶水,1350℃时 CaSO4开始分解;取纯净CaSO4xH2O固体3.44g,加热,测定固体质量随温度的变化情况如下图所示。

(1)0~T1固体质量没有发生变化的原因可能是_____________。
(2)G点固体的化学式是_________。
(3)将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,反应后的固体为氧化物,则则H~I段发生反应的化学方程式为__________;m=______。
【题目】为了测定液化气中丙烷(C3H8)在氧气不足时的燃烧产物,将一定量的丙烷和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
下列判断正确的是( )
A. X可能含有氢元素 B. X可能是该反应的催化剂
C. 表中a的值为5.6 D. X只含碳元素