题目内容
123、
溶质从溶液中以晶体的形式析出
的过程叫做结晶.使固体物质从溶液中结晶的方法有冷却热饱和溶液
和蒸发结晶
.对于溶解度随温度变化较大的固态物质,通过冷却热饱和溶液
使溶质从溶液中结晶析出,溶解度随温度变化不大的固态物质,通过蒸发结晶
使溶质结晶.提纯含少量NaCl的KNO3应采用冷却热饱和溶液
,提纯含少量KNO3的NaCl应采用蒸发结晶
.分析:根据结晶是从溶液中析出晶体的过程,结晶的方法有蒸发溶剂结晶和冷却热饱和溶液结晶,在考虑分离方法时通常要参考物质的溶解度受温度变化影响的大小.
解答:解:根据结晶的定义可以知道固体物质以晶体的形式从溶液中析出的过程称为结晶,常用的结晶的方法根据溶解度受温度的影响有冷却热饱和溶液和蒸发结晶两种方法,对于硝酸钾的溶解度受温度变化影响较大,所以常用冷却热饱和溶液的方法结晶提纯,而对于氯化钠的溶解度受温度变化影响不大,所以通常采用蒸发溶剂的方法结晶.
故答案为:溶质从溶液中以晶体的形式析出;冷却热饱和溶液;蒸发结晶;冷却热饱和溶液;蒸发结晶;冷却饱和溶液;蒸发结晶
故答案为:溶质从溶液中以晶体的形式析出;冷却热饱和溶液;蒸发结晶;冷却热饱和溶液;蒸发结晶;冷却饱和溶液;蒸发结晶
点评:了解结晶的定义,能够根据固体溶质受温度变化的影响大小来选择合适的结晶方法.

练习册系列答案
相关题目
某中学的初三学生计划在实验室中通过测定硝酸钾在不同温度下的溶解度以绘制出硝酸钾的溶解度曲线.具体实验方案:
①实验装置:
②实验步骤:取固定质量的硝酸钾固体于试管中,加入不同体积的水,将此试管放于热水浴中.用玻璃棒不断搅拌至硝酸钾全部溶解.从水浴中取出试管,插入温度计,用玻璃棒搅拌,当溶液中刚好出现晶体时,记录此时温度.重复上述实验两次,记录相应实验数据.
③数据处理:每组实验温度数据取其平均值,即为这种浓度的硝酸钾溶液恰好达到饱和状态时的温度.再求算在该温度下的溶解度,就能绘制出硝酸钾的溶解度曲线.
(1)以下是这些学生得到的相应实验数据,请你帮助他们完成表格中的空白处.(数据处理的原则:若一系列相关数据中,有其中一个数据与其余数据差别过大时,可舍去)
(2)根据上述实验数据绘制相应的溶解度曲线A.
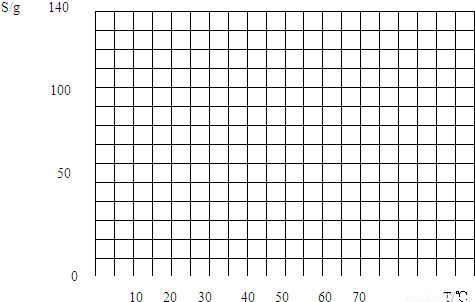
(3)以下是硝酸钾的溶解度表(真实值)
①根据此数据在上面坐标图中绘制硝酸钾(真实值)的溶解度曲线B.
②比较曲线A和B,试分析一下导致误差的原因可能有哪些?______.
(4)下表为氯化钠的溶解度表
①比较氯化钠和硝酸钾的溶解度表,写出KNO3和NaCl具有相同溶解度时的温度范围:______(限表中相邻两个温度之间).
②20℃时,200g溶质的质量分数为20%的NaCl溶液加热蒸发掉60g水后降温到20℃,试求此时从溶液中析出的NaCl的质量.
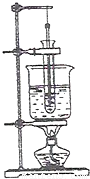
①实验装置:
②实验步骤:取固定质量的硝酸钾固体于试管中,加入不同体积的水,将此试管放于热水浴中.用玻璃棒不断搅拌至硝酸钾全部溶解.从水浴中取出试管,插入温度计,用玻璃棒搅拌,当溶液中刚好出现晶体时,记录此时温度.重复上述实验两次,记录相应实验数据.
③数据处理:每组实验温度数据取其平均值,即为这种浓度的硝酸钾溶液恰好达到饱和状态时的温度.再求算在该温度下的溶解度,就能绘制出硝酸钾的溶解度曲线.
(1)以下是这些学生得到的相应实验数据,请你帮助他们完成表格中的空白处.(数据处理的原则:若一系列相关数据中,有其中一个数据与其余数据差别过大时,可舍去)
| 实验组号 | KNO3/g | H2O/g | 刚好出现晶体时的温度/℃ | 平均温度/℃ | 溶解度/g | ||
| 一 | 4 | 3 | 66.5 | 67.0 | 69 | 67.5 | 133.3 |
| 二 | 4 | 5 | 45.8 | 45.2 | 45.5 | 45.5 | |
| 三 | 4 | 7 | 32.5 | 33.0 | 33.0 | ||
| 四 | 4 | 9 | 27.8 | 27.3 | 27.0 | 27.4 | 44.4 |
| 五 | 4 | 10 | 25.8 | 30.1 | 26.1 | 40.0 | |

(3)以下是硝酸钾的溶解度表(真实值)
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| KNO3/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
②比较曲线A和B,试分析一下导致误差的原因可能有哪些?______.
(4)下表为氯化钠的溶解度表
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl/g | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
②20℃时,200g溶质的质量分数为20%的NaCl溶液加热蒸发掉60g水后降温到20℃,试求此时从溶液中析出的NaCl的质量.

 某中学的初三学生计划在实验室中通过测定硝酸钾在不同温度下的溶解度以绘制出硝酸钾的溶解度曲线.具体实验方案:
某中学的初三学生计划在实验室中通过测定硝酸钾在不同温度下的溶解度以绘制出硝酸钾的溶解度曲线.具体实验方案: