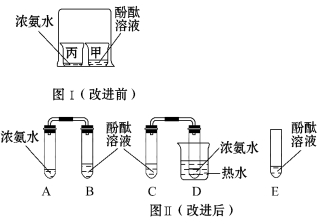
题目内容
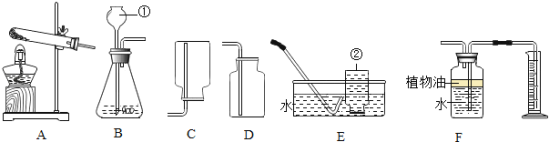
【题目】下图所示为实验室常用的实验装置:
据此回答下列问题:
(1)写出带标号仪器的名称:②_______________;
(2)常温下,实验室制取并收集较纯净氧气选择的装置组合是______(填序号,下同),化学方程式为___________________________________,其基本反应类型是_____________。
(3)F装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是___________.
(4)某同学在实验室用大理石与一定浓度盐酸制取二氧化碳,发现产生气体的速率太快,请你分析并写出可能的原因_______________________________,实验室检验二氧化碳的反应方程式是____________________________。
【答案】集气瓶 BE 2H2O2 ![]() 2H2O + O2↑ 分解反应 防止二氧化碳与水接触; 盐酸浓度大 CO2 + Ca(OH)2 = CaCO3 ↓ + H2O
2H2O + O2↑ 分解反应 防止二氧化碳与水接触; 盐酸浓度大 CO2 + Ca(OH)2 = CaCO3 ↓ + H2O
【解析】
(1)据图可知仪器②是集气瓶;
(2)常温下,实验室制取氧气时,应该是利用过氧化氢和二氧化锰制取,应该用B装置作为发生装置;因为氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用E装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净;反应的化学方程式为:2H2O2![]() 2H2O+O2↑,此反应属于分解反应;
2H2O+O2↑,此反应属于分解反应;
(3)F装置可用来测量生成的二氧化碳气体的体积,其中在上面放一层植物油的目的是防止二氧化碳溶于水;
(4)在实验室用大理石与稀盐酸制取二氧化碳时,发现产生气体的速率太快,原因可能是:盐酸的浓度过大,大理石是粉末状;二氧化碳能使澄清的石灰水变浑浊,是因为氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,反应方程式是:CO2+Ca(OH)2=CaCO3 ↓+H2O。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】已知锌与硫酸可以发生反应生成硫酸锌和氢气。某研究性学习小组在探究“影响锌与硫酸反应快慢的因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快。
(查阅资料)①锌与硫酸反应的符号表达式Zn + H2SO4 = ZnSO4 + H2
②锌与硫酸铜溶液反应的符号表达式Zn + CuSO4 = ZnSO4 + Cu
③硫酸溶液中含有H+、硫酸根离子(用化学用语表示_____________);硫酸铜溶液中含有Cu2+、硫酸根离子;硫酸锌溶液中含有Zn2+、硫酸根离子。
(提出问题)是什么离子导致产生氢气的速率加快?
(猜想假设)甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是_________。
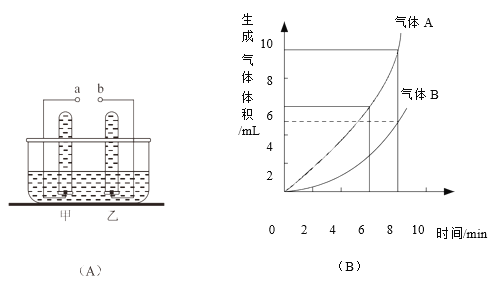
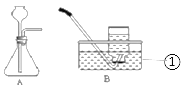
(实验验证)写出仪器①的名称__________。用A、B两组仪器进行实验:
步骤一:检查装置气密性。连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察到_______,即为气密性良好。
步骤二:量取2份质量分数为20%的稀硫酸各20mL,第一份加入质量分数为10%的硫酸铜溶液1mL,第二份加入质量分数为10%的硫酸锌溶液1mL。称取2份形状相同锌粒各1g,分别与以上溶液反应。反应装置如图A所示。用此装置实验时,长颈漏斗下端要插入液面以下,目的是__________。
步骤三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125mL)所需的时间(如下表),什么时间开始收集气体?__________。(填“气泡连续均匀”或“刚有气泡”)
编号 | 20%的稀硫酸各20mL | 锌粒 | 收集1瓶氢气所需的时间 |
① | 加入质量分数为10%的硫酸铜溶液1mL | 1g | 2分10秒 |
② | 加入质量分数为10%的硫酸锌溶液1mL | 1g | 3分01秒 |
(得出结论)硫酸中混有硫酸铜溶液时,产生氢气的速率加快与__________有关。实验②中加入质量分数为10%的硫酸锌溶液1mL的作用是__________。
(反思质疑)丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是__________。
(继续探究)请你设计一个实验方案验证丁同学的观点是否正确。
编号 | 实验步骤 | 实验现象比较 | 实验结论 |
① | 取1g锌粒于锥形瓶中, 加入20mL 20%的稀硫酸 | __________ | 产生氢气的速率较快与铜单质有关 |
② | __________ |
【题目】现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。

(1)下列方法能检查该装置气密性的是_______。
A.将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B.关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差。
C.关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差。
(2)甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究_________对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
(3)甲、乙两小组得出如下图数据。

①甲组实验得出的数据可知:浓度越大,H2O2分解速率_________;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据相同条件下, H2O2在_______(填“酸”或“碱”)性环境下放出气体速率较快