题目内容
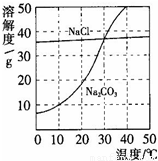
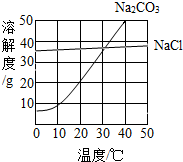
图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
(1)30℃时,氯化钠的溶解度 碳酸钠的溶解度(填写“>”、“<”或“=”);
(2)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是 溶液;
(3)将30℃时相同质量的两种物质的饱和溶液,分别降温到10℃,晶体析出较多的是 .
(4)要使接近饱和的碳酸钠溶液变为饱和溶液,可采取的一种措施是 .
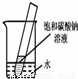
(5)如右图所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是 (填字母序号).
A.氢氧化钠 B.生石灰 C.硝酸铵 D.浓硫酸.
【答案】分析:根据固体物质的溶解度曲线可以:
(1)比较不同物质在同一温度下的溶解度大小;
(2)查出某物质在某温度下的溶解度,可以进行有关的计算;
(3)根据物质的溶解度随温度变化的变化情况,判断降低温度时从溶液中析出晶体的多少;
(4)判断物质的溶解度随温度变化的变化情况,判断要使接近饱和的碳酸钠溶液变为饱和溶液的方法;
(5)根据碳酸钠的溶解度随温度的升高而明显增加;20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.一定是溶液的温度降低而引起的,故可知加入的物质种类.
解答:解:(1)根据两物质的溶解度曲线可知,在30℃时,氯化钠和碳酸钠的溶解度曲线相交,所以,30℃时,氯化钠的溶解度等于碳酸钠的溶解度;
(2)在10℃时,氯化钠的溶解度大于碳酸钠的溶解度,所以,10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是氯化钠溶液;
(3)由溶解度曲线可知,碳酸钠的溶解度受温度变化的影响较大,将30℃时相同质量的两种物质的饱和溶液,分别降温到10℃,晶体析出较多的是碳酸钠;
(4)由于碳酸钠碳酸钠的溶解度随温度的升高而明显增加,所以,要使接近饱和的碳酸钠溶液变为饱和溶液,可采取的一种措施是降温;
(5)已知碳酸钠的溶解度随温度的升高而明显增加;在20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.一定是溶液的温度降低而引起的,故可知加入的物质可能是硝酸铵,故选C;因为氢氧化钠固体、生石灰、浓硫酸溶于水都是升温;
故答为(1)=;(2)氯化钠;(3)碳酸钠;(4)降温;(5)C.
点评:本题难度不是很大,主要考查了根据固体的溶解度曲线解决相关的问题,从而培养学生分析问题、解决问题的能力.
(1)比较不同物质在同一温度下的溶解度大小;
(2)查出某物质在某温度下的溶解度,可以进行有关的计算;
(3)根据物质的溶解度随温度变化的变化情况,判断降低温度时从溶液中析出晶体的多少;
(4)判断物质的溶解度随温度变化的变化情况,判断要使接近饱和的碳酸钠溶液变为饱和溶液的方法;
(5)根据碳酸钠的溶解度随温度的升高而明显增加;20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.一定是溶液的温度降低而引起的,故可知加入的物质种类.
解答:解:(1)根据两物质的溶解度曲线可知,在30℃时,氯化钠和碳酸钠的溶解度曲线相交,所以,30℃时,氯化钠的溶解度等于碳酸钠的溶解度;
(2)在10℃时,氯化钠的溶解度大于碳酸钠的溶解度,所以,10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是氯化钠溶液;
(3)由溶解度曲线可知,碳酸钠的溶解度受温度变化的影响较大,将30℃时相同质量的两种物质的饱和溶液,分别降温到10℃,晶体析出较多的是碳酸钠;
(4)由于碳酸钠碳酸钠的溶解度随温度的升高而明显增加,所以,要使接近饱和的碳酸钠溶液变为饱和溶液,可采取的一种措施是降温;
(5)已知碳酸钠的溶解度随温度的升高而明显增加;在20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.一定是溶液的温度降低而引起的,故可知加入的物质可能是硝酸铵,故选C;因为氢氧化钠固体、生石灰、浓硫酸溶于水都是升温;
故答为(1)=;(2)氯化钠;(3)碳酸钠;(4)降温;(5)C.
点评:本题难度不是很大,主要考查了根据固体的溶解度曲线解决相关的问题,从而培养学生分析问题、解决问题的能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
 27、如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
27、如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题: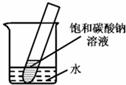
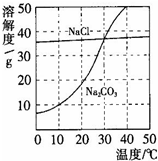 如图为氯化钠、碳酸钠在水中的溶解度曲线.
如图为氯化钠、碳酸钠在水中的溶解度曲线.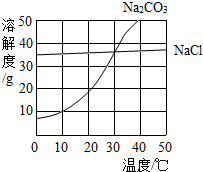 (2012?花都区一模)图为氯化钠、碳酸钠在水中的溶解度曲线.
(2012?花都区一模)图为氯化钠、碳酸钠在水中的溶解度曲线.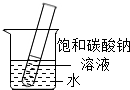
 (2013?佛山)如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题;
(2013?佛山)如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题;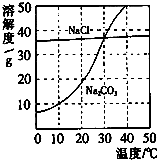 如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题: