题目内容
某课外活动小组利用稀硫酸测定粗锌中纯锌的含量。现称取粗锌20g,加入到足量硫酸溶液中充分反应(杂质不参与反应),测得数据如下表:
(1)计算反应过程中产生氢气的质量。
(2)根据表中数据计算粗锌中锌的质量分数。
| 时间/min | 0 | 3 | 6 | 9 |
| 粗锌及溶液总质量/g | 150.4 | 150.2 | 150.0 | 150.0 |
(2)根据表中数据计算粗锌中锌的质量分数。
解:(1)0.4g
(2)65%
(2)65%
(1)根据质量守恒定律,反应前后减少的质量为氢气的质量.
20g粗锌与稀硫酸充分反应产生氢气的质量为:
150.4g ﹣150.0g = 0.4g ----------------(1分)
(2)利用锌与硫酸反应的化学方程式,根据氢气的质量求出锌的质量,最后根据
 ×100%可求出粗锌中锌的质量分数
×100%可求出粗锌中锌的质量分数
设20g粗锌中锌的质量为x
Zn + H2SO4 === ZnSO4 + H2↑ ---------------(1分)
65 2
x 0.4g
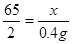 -----------------(1分)
-----------------(1分)
x=13.0g -----------------(1分)
粗锌中锌的质量分数为= ---------(1分)
---------(1分)
20g粗锌与稀硫酸充分反应产生氢气的质量为:
150.4g ﹣150.0g = 0.4g ----------------(1分)
(2)利用锌与硫酸反应的化学方程式,根据氢气的质量求出锌的质量,最后根据

 ×100%可求出粗锌中锌的质量分数
×100%可求出粗锌中锌的质量分数设20g粗锌中锌的质量为x
Zn + H2SO4 === ZnSO4 + H2↑ ---------------(1分)
65 2
x 0.4g
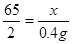 -----------------(1分)
-----------------(1分)x=13.0g -----------------(1分)
粗锌中锌的质量分数为=
 ---------(1分)
---------(1分)
练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目