题目内容
【题目】氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是
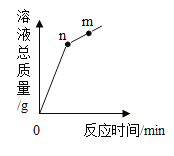
A.该实验是将氧化铜逐渐加入稀盐酸中
B.n点和m点对应溶液中铜元素质量不相等
C.n点和m点对应溶液蒸发结晶后得到的固体成分相同
D.n点和m点对应溶液中溶质成分相同
【答案】C
【解析】
A、图像起点位置为“0”,即溶液质量为“0”,该实验是将稀盐酸加入到氧化铜中;故选项错误;
B、由图像可知,拐点位置表示氧化铜与稀盐恰好完全反应,n点和m点对应溶液中铜元素质量相等;故选项错误;
C、n点时溶液中有氯化铜和水,m点时,加入稀盐酸过量,溶液中有氯化铜、氯化氢和水,对应溶液蒸发结晶后,水和氯化氢全部挥发,得到的固体成分都只有氯化铜;故选项正确;
D、n点表示稀盐酸与氧化铁恰好完全反应,溶质是氯化铜,m点表示稀盐酸过量,溶质是氯化铜和氯化氢,溶液中溶质成分不相同;故选项错误;
故选:C。

【题目】2018年5月18日我国第一艘国产航母试海成功,航母的许多电字元件使用了黄铜。为测定某黄铜(假设合金中仅含铜,锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为____________g。
(2)该黄铜中铜的质量分数为多少?(写出计算过程)____________
【题目】在学习碱的性质时,同学们发现碱溶液都具有一些相似的化学性质,原因是它们在水中都能解离出相同的_____(填离子符号)。
某实验小组在探究碱的化学性质时,有位同学不小心将氢氧化钠和氢氧化钙两种溶液混合在一起,发现有白色沉淀生成,经验证该瓶氢氧化钠溶液已部分变质,氢氧化钠变质的原因是_____(用化学方程式表示)。
(提出问题)如何将这瓶部分变质的氢氧化钠溶液中的杂质除去呢?
(设计实验)
方案 | 实验操作 | 实验现象 | 结论 |
方案一 | 取适量样品于试管中,滴加稀盐酸 | 有_____杂质已除去 | |
方案二 | 取适量样品于试管中,滴加Ca(NO3)2溶液,过滤 | 有_____ | 杂质已除去 |
方案三 | 取适量样品于试管中,滴加Ca(OH)2溶液,过滤 | 有白色沉淀生成 | 杂质已除去 |
上述实验操作中所用试剂正确的是方案_____。
该实验小组用正确的试剂进行了实验。小墨提出质疑,杂质是否已经完全除去?于是他取适量实验后的溶液于试管中,继续加入所用的正确试剂,观察到_____的现象,说明杂质没有完全除去。
(归纳总结)
(1)氢氧化钠必须密封保存;
(2)同学们针对上述三个方案认真讨论后得出,要除去物质中含有的杂质,选用试剂时应考试的因素有:不与所需物质反应、只和杂质反应、试剂要适量。