题目内容
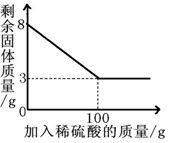
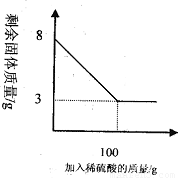
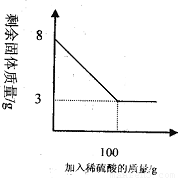
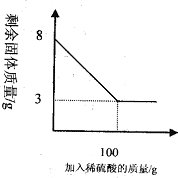 小明同学为测定某种混合物(成分为Fe2O3和C)中Fe2O3含量,称取8g样品与足量稀硫酸反应,得到数据如下图所示.请回答下列问题:
小明同学为测定某种混合物(成分为Fe2O3和C)中Fe2O3含量,称取8g样品与足量稀硫酸反应,得到数据如下图所示.请回答下列问题:(1)氧化铁中氧元素与铁元素的质量比为
3:7
3:7
;氧化铁中铁元素的质量分数为70%
70%
.(2)样品中Fe2O3的质量分数为
62.5%
62.5%
.(3)计算该稀硫酸的溶质质量分数,(写出计算过程,结果精确到0.1%)
分析:(1)根据氧化铁的化学式结合元素的相对原子质量来解答该题;
(2)根据图中所给信息可以知道剩余的3g固体为C的质量,可以据此来求算Fe2O3的质量分数;
(3)根据氧化铁的质量及消耗的稀硫酸的质量结合化学方程式来求算稀硫酸的质量分数.
(2)根据图中所给信息可以知道剩余的3g固体为C的质量,可以据此来求算Fe2O3的质量分数;
(3)根据氧化铁的质量及消耗的稀硫酸的质量结合化学方程式来求算稀硫酸的质量分数.
解答:解:(1)氧化铁指氧元素和铁元素的质量比为:(16×3):(56×2)=48:112=3:7;
其中铁元素的质量分数为:
×100%=70%;
(2)根据图中信息可以知道剩余的3g固体为碳的质量,所以氧化铁的质量为:8g-3g=5g;
样品中Fe2O3的质量分数为:
×100%=62.5%;
(3)设与氧化铁反应的硫酸的质量为x
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294
5g x
=
解得:x=9.2g
所以该稀硫酸的溶质质量分数为:
×100%=9.2%.
故答案为:(1)3:7;70%;
(2)62.5%;
(3)9.2%.
其中铁元素的质量分数为:
| 56×2 |
| 56×2+16×3 |
(2)根据图中信息可以知道剩余的3g固体为碳的质量,所以氧化铁的质量为:8g-3g=5g;
样品中Fe2O3的质量分数为:
| 5g |
| 8g |
(3)设与氧化铁反应的硫酸的质量为x
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294
5g x
| 160 |
| 294 |
| 5g |
| x |
解得:x=9.2g
所以该稀硫酸的溶质质量分数为:
| 9.2g |
| 100g |
故答案为:(1)3:7;70%;
(2)62.5%;
(3)9.2%.
点评:熟练掌握化学式的相关计算以及根据化学方程式的计算,要注意解题格式.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目