题目内容
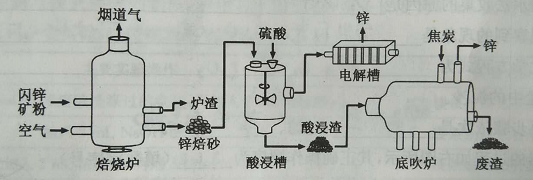
【题目】粗盐中MgCl2、CaCl2等杂质,提纯粗盐的工艺流程如图所示:

回答下列问题:
(1)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要用大量的水冲洗,再涂上 。
(2)步骤②加入过量的碳酸钠溶液的作用是 。
(3)操作a的名称是 。
(4)步骤④中,要用玻璃棒不断搅拌,其目的是 。
【答案】
(1)硼酸溶液
(2)完全除去氯化钙
(3)过滤
(4)防止液体受热不均匀,造成液体飞溅
【解析】
试题分析:
(1)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液。
(2)钙离子可用碳酸根离子来除去,氯化钙能与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,步骤②加入过量的碳酸钠溶液的作用是完全除去氯化钙。
(3)操作a是将白色沉淀与滤液分离,故操作a的名称是过滤。
(4)步骤④,是将食盐水变为精盐,采用的是蒸发操作,步骤④中,要用玻璃棒不断搅拌,其目的是防止液体受热不均匀,造成液体飞溅。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】图1是某兴趣小组在学习碱的性质时进行的探究活动,请要求回答问题。

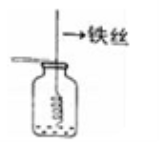
(1)通过分析实验一可知,氢氧化钠会吸收空气中的________.
(2)实验二中观察到3个塑料瓶变瘪的程度为A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,其中C瓶在实验中起 _________作用。
(3)晓晓查阅资料了解到往Ba(OH)2溶液中滴加或通入下列图2中物质会产生如下现象:A中溶液显红色,B、C、D中均产生白色沉淀.
①写出D试管中反应的化学方程式 _________.
②不同的碱溶液中都含有OH﹣,所以,碱有一些相似的化学性质.上述关于Ba(OH)2性质的实验不能体现碱的相似性质的是 _________(填字母序号)
(4)冬冬发现工业上使用的氢氧化钠固体标签如图3所示,于是对其所含杂质进行了探究.
【提出问题】 _________
【提出猜想】
猜想I:查阅资料可知,工业用氢氧化钠可能含有NaCl.
猜想Ⅱ:工业用氢氧化钠可能含有Na2CO3,原因是 _________(用简洁的文字表述).
【进行实验】
实验步骤 | 实验现象 | 解释或结论 |
①取适量固体样品于试管中,加水溶解 | 固体全部溶解 | / |
②向①所得溶液中滴加过量的 _________ | 一开始无明显变化,一会儿后产生能使澄清石灰水变浑浊的气体 | 样品中含有Na2C03 |
③向②所得溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有NaCl.反应的化学方程式为 _________ |