题目内容
钙是维持人体正常功能所必需的元素。钙尔奇是常用的补钙剂,主要成分是CaCO3,钙尔奇每片2.0g。取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应)。烧杯内物质质量变为11.34g。试计算:
① 反应产生二氧化碳 (18) g,是 (19) mol;
② 每片钙尔奇中含碳酸钙 (20) mol;
③ 服用钙尔奇通常一日2次,每次1片。则每人每天摄入钙元素的质量为 (21) g。
④ 根据化学方程式列式计算上述反应所用稀盐酸溶质的质量分数(精确到0.01%)
(22)
(18)0.66 (19)0.015 (20)0.015 (21)1.2
(22)设:盐酸中氯化氢为x mol
CaCO3 +2HCl →CaCl2 +H2O + CO2↑(1分,化学式正确就得分)
1 2
0.015 x
 =
= 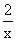 (1分) x = 0.03 mol (1分)
(1分) x = 0.03 mol (1分)
盐酸的质量分数 = 
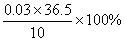 = 10.95% (1分)
= 10.95% (1分)
(方程式不配平,本空方程式+列式 得2分,计算结果不得分;
化学方程式错误,28(22)空得0分)

练习册系列答案
相关题目
 钙是维持人体正常功能所必需的元素.右图所示为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.试计算:
钙是维持人体正常功能所必需的元素.右图所示为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.试计算: 钙是维持人体正常功能所必需的元素.右图所示为某种补钙剂“钙尔奇”说明书的一部分.试进行有关的计算:
钙是维持人体正常功能所必需的元素.右图所示为某种补钙剂“钙尔奇”说明书的一部分.试进行有关的计算: (2009?邵阳)钙是维持人体正常功能所必需的元素.小芳服用的某种钙片的部分说明如图1,她很想知道每天服用的钙片中碳酸钙的质量.于是在家中进行了探究:取2片钙片,放人玻璃杯中,向其中加入60g 白醋,两者恰好完全反应(假设钙片中其他成分不与醋酸反应),测得玻璃杯中物质的质量(m)与反应时间(t)的关系如图2所示.反应的化学方程式:
(2009?邵阳)钙是维持人体正常功能所必需的元素.小芳服用的某种钙片的部分说明如图1,她很想知道每天服用的钙片中碳酸钙的质量.于是在家中进行了探究:取2片钙片,放人玻璃杯中,向其中加入60g 白醋,两者恰好完全反应(假设钙片中其他成分不与醋酸反应),测得玻璃杯中物质的质量(m)与反应时间(t)的关系如图2所示.反应的化学方程式: 钙是维持人体正常功能所必需的元素.图为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.(反应方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑)
钙是维持人体正常功能所必需的元素.图为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.(反应方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑)