题目内容
【题目】赣南的客家围屋如同城堡,可以抵御外敌入侵。现有五种物质盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠作为围屋的守护“卫士”,只有相邻物质间能发生反应才能组成守护的防线(如图所示)。其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分。(提示:碳酸钡不溶于水)
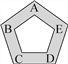
(1)A物质是________;
(2)B与C反应的化学方程式为__________________________________;A与E反应时的实验现象为________________________________;
(3)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质与两位相邻的守护“卫士”都能发生反应才能攻破防线,那么能攻入围屋的物质是________。(填序号)
①铁 ②氧化铁 ③二氧化碳 ④氢氧化钡
【答案】 H2SO4 NaOH+HCl===NaCl+H2O 产生白色沉淀 ④
【解析】只有相邻物质间能发生反应才能组成守护的防线。A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分。A是浓硫酸,B是氢氧化钠,C是盐酸,D是碳酸钠,E是氯化钡。(1)A物质是H2SO4;(2)B与C反应的化学方程式为∶NaOH+HCl=NaCl+H2O;A与E反应时的实验现象为产生白色沉淀;(3) 若该物质与两位相邻的守护“卫士”都能发生反应才能攻破防线,那么能攻入围屋的物质是氢氧化钡,可以与盐酸反应,也可以与碳酸钠反应。
点睛∶这是一道推断题,掌握常见物质的性质是对学生的基本要求,是做好本题的关键。充分利用复分解反应的条件,是判断酸碱盐反应的重要依据。

 小题狂做系列答案
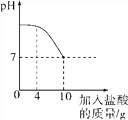
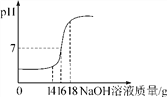
小题狂做系列答案【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定反应后溶液的pH,得到了如图所示的pH曲线,请回答:

(1)由图可知该实验操作是将______________滴加到另一种溶液中。
(2)该反应的化学方程式为__________________________________________。
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了做标记,他设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3===CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现____________________________的现象。结论:该样品是a处溶液。
②为进一步确定b和c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液 | ________________________ | 该样品为b处溶液 |
先有____________产生,后有________________产生 | 该样品为c处溶液,并推知溶液中的阳离子有________________ |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑________________________________。