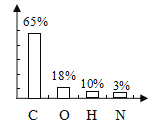
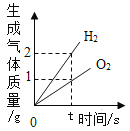
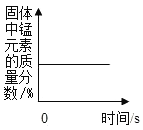
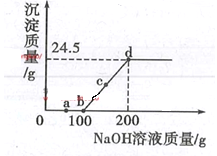
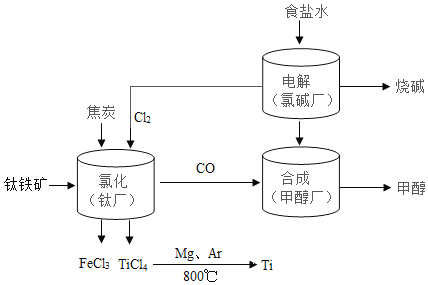
题目内容
【题目】同学们在完成铁与硫酸铜反应的实验后,欲从废液(含硫酸铜和硫酸亚铁)中回收金属铜,并得到硫酸亚铁,其设计的流程如下:
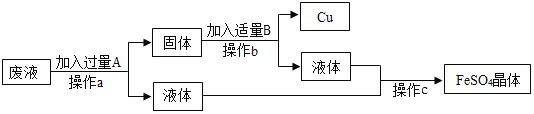
(1)操作a的名称是_____________。
(2)操作a、 b和c中都需要用到的玻璃仪器是____________________,其在操作c中的作用是___________________。
(3)写出流程中固体的成分是__________________(写化学式),写出加入过量A时反应的化学方程式____________________________________。
【答案】过滤 玻璃棒 搅拌,防止局部过热,液滴飞溅(使溶液受热均匀) Cu、Fe ![]()
【解析】
废液中含硫酸铜和硫酸亚铁,可向废液中加入过量铁,铁与硫酸铜反应生成硫酸亚铁和铜,过滤,可得铁和铜的混合固体和硫酸亚铁溶液,故A是铁,a是过滤;固体中含铁和铜,要想得到铜,可加入适量稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,使铁溶解,过滤,故操作b为溶解、过滤;可得硫酸亚铁溶液和铜,故B为硫酸;将硫酸亚铁经过蒸发可得硫酸亚铁晶体。
(1)通过过滤可使固体与液体分离,故操作a是过滤;
(2)操作a、 b和c分别是过滤,溶解、过滤,蒸发,三步操作都要用到玻璃棒,蒸发时玻璃棒的作用是搅拌,防止局部过热,液滴飞溅;
(3)由分析可知,固体的成分是铜和铁;
欲从废液(含硫酸铜和硫酸亚铁)中回收金属铜,并得到硫酸亚铁,加入过量铁,铁与硫酸铜反应生成硫酸亚铁和铜,该反应的化学方程式为:![]() 。
。

 53天天练系列答案
53天天练系列答案【题目】某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用![]() 石灰石样品,把
石灰石样品,把![]() 稀盐酸(氯化氢的水溶液)分
稀盐酸(氯化氢的水溶液)分![]() 次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
实验次数 | 第 | 第 | 第 | 第 |
加入稀盐酸的质量 |
|
|
|
|
剩余固体的质量 |
|
|
|
|
(1)上表中![]() 的数值为_____.由上表数据可知这四次实验中,第____次所加的盐酸没反应完.
的数值为_____.由上表数据可知这四次实验中,第____次所加的盐酸没反应完.
(2)石灰石样品中碳酸钙的质量分数是?.
(3)如果该石灰厂煅烧![]() 这种石灰石,最多可得到二氧化碳气体多少吨?(本小题要求写出完整的计算过程,结果保留小数点后
这种石灰石,最多可得到二氧化碳气体多少吨?(本小题要求写出完整的计算过程,结果保留小数点后![]() 位)
位)
【题目】某校初三学生去西樵山春游,带回了几块石灰石样品。为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用质量分数相同的盐酸与样品充分反应来进行测定![]() 假设样品中的杂质不溶于水,且不与盐酸反应
假设样品中的杂质不溶于水,且不与盐酸反应![]() ,测得数据如表:
,测得数据如表:
甲 | 乙 | 丙 | 丁 | |
均匀研磨后的石灰石样品质量 |
|
|
|
|
盐酸的质量 |
|
|
|
|
剩余固体的质量 |
|
|
|
|
试问答:
(1)![]() 样品与
样品与![]() 盐酸充分反应后,盐酸是否有剩余______
盐酸充分反应后,盐酸是否有剩余______ ![]() 填“是”或“否”
填“是”或“否”![]() ;样品中碳酸钙的质量分数是______。
;样品中碳酸钙的质量分数是______。
(2)计算所用盐酸的质量分数![]() 写出计算过程
写出计算过程![]()
(3)画出![]() 样品与
样品与![]() 盐酸混合后产生二氧化碳的质量与盐酸的关系图。
盐酸混合后产生二氧化碳的质量与盐酸的关系图。

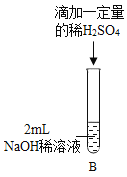
【题目】某化学兴趣小组在实验室做了如图所示的A,B两个实验。
|
|
|
(1)B实验中发生反应的化学方程式为____;
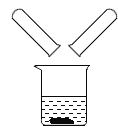
(2)A,B两个实验结束后,将沉淀过滤,小组同学将两只试管中的物质同时倒入一洁净的烧杯中(如图所示),混合后,观察到烧杯中有蓝色沉淀。同学们将烧杯内的物质过滤,对所得滤液中溶质的成分进行探究 。
(猜想)小明:滤液中的溶质是Na2SO4 、CuSO4;
小光:滤液中的溶质是Na2SO4、NaOH;
小英:滤液中的溶质是Na2SO4、CuSO4、H2SO4;
你的:滤液中的溶质还可能是____ ;
(3)(讨论)你认为______的猜想一定不合理,理由是___;
如果滤液为无色,还可排除谁的猜想且理由是____ ;
(实验)若小光的猜想正确,请完成下表的方案。
实验步骤 | 预期的实验现象 | 实验结论 |
取少量溶液于试管中,滴入 ____ | ____ | 小光的猜想正确 |