题目内容
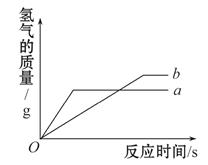
用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如图所示。
请回答下列问题:
(1)表示锌粉与稀盐酸反应的曲线为 (填a或b)。
(2)对于a曲线表示的反应,物质 (填名称)有剩余。

请回答下列问题:
(1)表示锌粉与稀盐酸反应的曲线为 (填a或b)。
(2)对于a曲线表示的反应,物质 (填名称)有剩余。
(1)a (2)稀盐酸
锌比铁活泼,与酸反应速度快,即在相同时间内产生氢气的质量大,所以曲线a为锌粉与稀盐酸反应的曲线,曲线b为铁粉与稀盐酸反应的曲线。由图看出,锌最终产生的氢气质量比铁产生的少,铁、锌与盐酸反应的化学方程式分别为:Fe+2HCl=FeCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,由化学方程式中各物质间的质量比知,两个反应中酸不可能都完全反应(若酸完全反应,则生成的氢气质量相等), 又因为相同质量的铁和锌完全反应,铁消耗的酸和产生的氢气质量比锌多,在这种情况下,与锌反应的稀盐酸一定有剩余。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目


 2Fe2O3
2Fe2O3