��Ŀ����
����Ŀ������кͷ�Ӧ�����ձ���ʢ��Լ5ml������������Һ�����뼸����ɫ��̪��Һ��Ȼ���ý�ͷ�ι���ȡϡ�����������뵽�ձ��У����ò��������Ͻ��裮����ͼ��ʾ�� 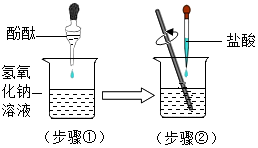
��1���μӷ�̪�������� ��
��2��ϡ����Ҫ���������Ŀ���� ��
��3���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��4��ijͬѧ��ʵ��ʱ����ϡ����һ���Եμӵ��ձ��У���Һ�����Ӻ�ɫ��Ϊ��ɫ������Ϊ���ǡ���кͣ���ʦ�����������ǽ��۲���ȷ������Ϊ��ʦ�������� ��
���𰸡�
��1���ж�����Ƿ�ǡ����ȫ�к�
��2������������������ֹ����
��3��NaOH+HCl=NaCl+H2O
��4��������ܹ����������ʹ��̪��ɫ
���������⣺��1�����кͷ�Ӧ�У�����������Һ�Լ��ԣ������̪��Һ����ɫ�����ŵμ�ϡ���ᣬ��Һ�ļ��Լ�����ǡ����ȫ��Ӧʱ����Һ�����ԣ���Һ�������ɫ������ж�����Ƿ�ǡ����ȫ�кͣ���2�����ڸ�ʵ���һ��������̽��������Һ�Ƿ�ǡ����ȫ��Ӧ��ϡ����Ҫ���������Ŀ����Ϊ�˷�ֹ������Һ�������������������������ֹ��������3���������ƺ����ᷴӦ�Ļ�ѧ����ʽ�� NaOH+HCl�TNaCl+H2O�����NaOH+HCl=NaCl+H2O����4��������Һ��������Һ������ʹ��ɫ�ķ�̪��Һ���ɫ����������һ���Ե��������Һ����ɫ���������п��ܹ��������������ܹ����������ʹ��̪��ɫ��
�����㾫����������Ҫ�������кͷ�Ӧ����Ӧ�ú���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ�㣬��Ҫ�����кͷ�Ӧ����������������κ�ˮ�ķ�Ӧ��ע�⣺a����ƽ b������ c�����Ų�����ȷ�����⣮

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��һЩʳ�����pH���±�
ʳ�� | ���� | ţ�� | ������ | ƻ��֭ |
pH | 4.0��4.4 | 6.3��6.6 | 7.6��8.0 | 2.9��3.3 |
������˵������ȷ���� �� ��
A.θ��������Ӧ��ʳƻ��
B.����֭��������ʳƷ
C.ţ�̺ͼ������Ϊ����ʳƷ
D.ƻ��֭���Ա�ţ��ǿ