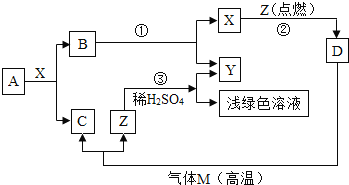
题目内容
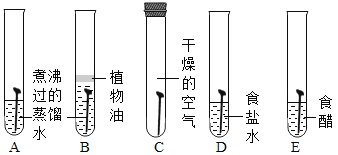
【题目】某同学为了探究相关金属的化学性质,做了下列实验:
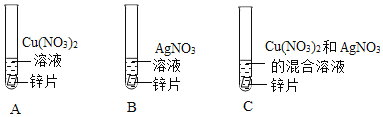
(1)A试管中实验现象是_____。
(2)只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂合理的是_____,写出该反应的化学方程式_____。
A Cu、Ag、稀盐酸 B Cu、AgNO3溶液 C Cu、AgCl
(3)实验C中物质充分反应后,某同学对试管中固体的成分提出以下四种猜想:
A Zn、Cu、Ag B Zn、Cu C Cu、Ag D Ag
这四种猜想中明显不合理的是_____(填编号,下同),随后该同学对试管中的固体进行了以下探究:取固体少量于试管中,滴加稀盐酸,固体表面产生气泡;由此可判断该固体的成分是_____。
【答案】锌片表面覆盖一层红色物质,溶液由蓝色变成无色 B Cu+2AgNO3=Cu(NO3)2+2Ag B A
【解析】
(1)A试管中锌和硝酸铜反应生成硝酸锌和铜,实验现象是锌表面析出红色固体,溶液由蓝色逐渐变为无色;
(2)锌和硝酸铜反应生成硝酸锌和铜,锌和硝酸银反应生成硝酸锌和银,说明锌的活动性大于铜,锌的活动性大于银,不能说明铜和银活动性强弱,只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂合理的是Cu、AgNO3溶液,是因为铜能和硝酸银反应生成硝酸铜和银,说明铜比银活泼。故选B;反应的化学方程式为:2AgNO3+Cu=Cu(NO3)2+2Ag;
(3)在金属活动顺序中,锌强于铜,铜强于银,锌先和硝酸银反应生成硝酸锌和银,后和硝酸铜反应生成硝酸锌和铜,如果滤渣中含有铜,则一定含有银。这四种猜想中明显不合理的是B。故选B;取固体少量于试管中,滴加稀盐酸,固体表面产生气泡,固体中一定有锌;由此可判断该固体的成分是Zn、Cu、Ag。故选A。

【题目】某小组探究硝酸钾固体的溶解情况,KNO3 在 20℃水中达到饱和时溶解的质量表格,依据如下测定数据分析正确的是( )
水的质量(g) | 25 | 50 | 100 |
KNO3的质量(g) | 7.9 | 15.8 | 31.6 |
A.KNO3溶解后形成的溶液各部分密度相同
B.KNO3 的溶解度随水量的增加而增大
C.20℃时,KNO3饱和溶液的质量分数为 31.6%
D.仅从以上实验数据无法推测KNO3溶解度受温度的影响关系