题目内容
【题目】菱铁矿(主要成分是碳酸亚铁)是炼铁的原料之一,现取20.0 g菱铁矿,向其中加入足量稀硫酸,充分反应(菱铁矿中的杂质不参加反应,且难溶于水),测得固体质量与所加稀硫酸的质量关系如图所示。

(1)20.0 g菱铁矿中FeCO3的质量分数为________%。
(2)列式计算,恰好完全反应时所得溶液的质量。______
(3)向上述所得溶液中加入____________g水,能得到10%的硫酸亚铁溶液,用于缺铁花卉的营养液。
【答案】58 解:设生成FeSO4质量为x,CO2质量为y,
FeCO3+H2SO4=FeSO4+CO2![]() +H2O
+H2O
116 142 44
11.6g x y
![]() ,x=15.2g
,x=15.2g
![]() ,y=4.4g
,y=4.4g
恰好完全反应时,所得溶液的质量为20.0 g-8.4 g+50.0 g-4.4 g=57.2 g
答:恰好完全反应时,所得溶液的质量为57.2 g。 94.8
【解析】
(1)20.0g菱铁矿中FeCO3的质量为:20.0g-8.4g=11.6g,菱铁矿中FeCO3的质量分数=![]()
![]() 100%=58%;
100%=58%;
(2)设生成FeSO4质量为x,CO2质量为y,
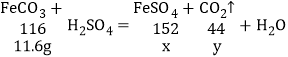
![]()
![]()
X=15.2g y=4.4g
恰好完全反应时,所得溶液的质量为20.0 g-8.4 g+50.0 g-4.4 g=57.2 g;
(3)设需要水的质量为z,由题意可得:![]() 100%=10%,z=94.8g。
100%=10%,z=94.8g。

练习册系列答案
相关题目